支原体检测培养法是生物制剂质量控制的关键环节,湖州申科提供的 USP 支原体培养法检测服务,严格遵循USP<63 mycoplasma tests(culture method)>标准,为生物制剂开发与生产提供可靠保障。该方法适用于检测组织或细胞培养物、消化肉液及其他疑似支原体污染的材料,是确保生物技术产品及生产用材料合规性的必要要求。检测周期约 29 天,流程需满足双重要求:每批次培养基必须进行营养特性测试,确保检测效能;供试品需完成抑制物质检测,若生产方法发生变化可能影响检测结果,需重复该测试,避免抑制成分干扰支原体检出,保障检测结果的准确性与可靠性。
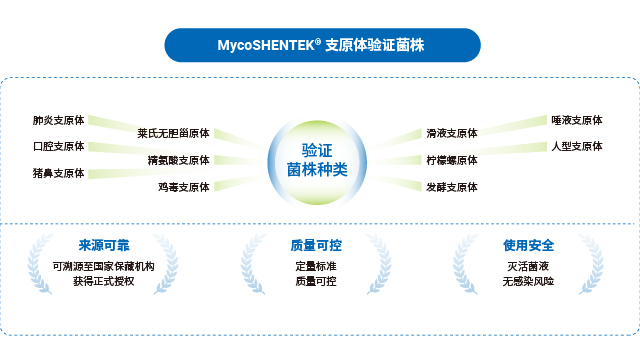
支原体检测试剂盒需覆盖常见污染菌株,避免因菌株遗漏导致漏检。干细胞产品支原体检测技术服务
支原体检测中,污染引发的假阳性是生物制品企业的痛点。实验室环境控制不当、人员操作不规范、仪器耗材混用等因素,都可能导致核酸气溶胶污染或上样污染,进而影响检测结果。一旦出现假阳性,企业需花费大量时间排查验证,严重时会导致批次报废、影响其他产品正常生产。常规 NAT 检测法虽比传统培养法快速,但仍存在明显短板:需配备前处理设备、PCR 仪器等多重耗材,核酸提取、PCR 上机、高浓度产物处理等多个环节均有污染风险;实验准备需 40-60 分钟,操作耗时超 4 小时,每天只能完成 1-2 轮单一类型样本检测,且对场地和人员技能要求极高,需单独划分试剂准备区、样品制备区等多个区域,人力与场地成本高昂。
辽宁免疫细胞产品支原体检测培养法培养基、血清等原辅料入库前需做支原体检测,排除外源污染风险。
湖州申科 MycoSHENTEK® 支原体检测解决方案以合规性为中心,具备突出的验证优势。该方案的试剂盒已完成 FDA 的 DMF 备案,经过 FDA 严格审核确认准确性与合规性,企业可直接引用备案信息,简化海外申报流程,降低审查不确定性,减少材料准备周期。方案通过了与合规机构的三方验证,联合合规机构获取标准菌株盘、建立 GC 比检测方法,共同开展提取效率验证、引物设计优化、反应体系与仪器程序开发,并由合规机构指导参与室间验证及检测限、专属性、耐用性等关键性能验证,严谨性与专业性获得行业认可。此外,方案还能为企业提供 NDA/BLA 申报验证支持,降低申报风险,同时涵盖试剂盒、设备、菌株、检测验证服务、现场审计等全流程服务,一站式解决企业整合成本高、流程复杂的痛点。
AdvSHENTEK外源因子全自动核酸检测分析系统以 “迷你 qPCR 实验室” 的创新形态,突破了传统支原体检测的场地限制。整套系统尺寸为 380mm×305mm×343mm,重量只有 14kg,体积小巧、易于部署,无需专门的 PCR 实验室,只需一间普通实验室即可满足检测需求,大幅降低了企业的场地投入成本。这与传统 NAT 法需严格划分试剂准备区、样本制备区、扩增区等多个功能区域的要求形成鲜明对比,尤其适合场地资源紧张的中小企业。同时,系统一体化设计减少了耗材搭配与损耗,自动化流程降低了人为操作失误导致的重复检测成本,从场地、人力、耗材多维度为企业实现降本增效,让支原体检测更具经济性。
申科依托 CNAS 认证实验室提供支原体检测服务,可配合监管机构现场审计,确保合规性。
阴性翘尾是支原体 NAT 检测中常见的异常现象,表现为 NCS 或 NTC 出现扩增信号,Ct 值多在 35~40 之间,需科学评估并处理。首先考虑污染因素,可能是阴性对照被阳性样本、试剂或环境气溶胶污染,建议立即复测,复测时使用带滤芯低吸附 TIP 头,严格执行阴阳性分区操作,注重细节防控。其次需排除背景信号等非典型性扩增的干扰,避免误判为污染。若前期验证中频繁出现 NTC 或 NCS 扩增,且已彻底排除污染可能性,可结合已有实验数据重新设置 Cut off 值,确保阈值线能有效区分真实阳性与背景信号,满足实验室检测需求。
全血基质中100 CFU/mL支原体,湖州申科支原体检测试剂盒通过优化提取流程实现稳定扩增与检出。上海干细胞产品支原体检测可比性验证
湖州申科提供支原体检测 qPCR 法方法学验证服务,含检测限、专属性、可比性等全维度验证。干细胞产品支原体检测技术服务
可比性验证是支原体检测 NAT 方法替代传统检测方法的关键依据,法规明确要求需将 NAT 法与药典规定的传统方法进行检测限(LOD)对比。若以 NAT 法替代培养法,需证实其检测限≤10CFU/mL;替代指示细胞培养法时,每种被测支原体的检测限需≤100CFU/mL。对比实验需采用相同样本同步开展 NAT 检测与传统方法检测,通过 CFU 可比性分析,确保两种方法的检测结果具有一致性。这一要求既保障了新方法的检测效能不低于传统标准,又为生物制品企业切换检测方法提供了合规依据,兼顾了效率提升与质量安全。
干细胞产品支原体检测技术服务