湖州申科在宿主细胞蛋白(HCP)ELISA 检测技术领域具备深厚技术积累,已成功搭建高质量全流程自有开发平台,覆盖 HCP 检测试剂盒研发的关键环节:①抗原表征与制备:依托合规平台的 HCP Reference/Antigen 制备能力,采用 2D 凝胶电泳等先进技术保障抗原库的代表性;②动物免疫与抗体制备:凭借自有免疫动物平台,把控免疫原设计及动物免疫流程,获得高特异性、广覆盖度的抗体;③体系开发与验证:借助成熟技术经验开发高灵敏度、高稳定性检测体系,且严格依照 GMP 标准完成方法学验证。该平台通过全流程自主可控的技术整合,从源头保障试剂盒性能的一致性与可靠性,降低不同批次试剂盒的检测变异性。其研发的 HCP ELISA 试剂盒已成功为国内外 200 余家生物医药企业提供服务,为单抗、疫苗等生物制品的工艺开发、质量控制及 IND/BLA 等法规申报,提供符合监管要求的定制化检测解决方案。
临床 III 期及商业化生产阶段,法规推荐用定制化 HCP ELISA 试剂盒保障检测针对性。北京通用型宿主细胞蛋白(HCP)残留检测方法开发
方法选择是影响宿主细胞蛋白(HCP)残留检测结果的因素之一。酶联免疫吸附法(ELISA)与液相色谱 - 质谱联用技术(LC-MS),是当前 HCP 检测领域的两类常用方法。据文献统计,当前在总 HCP 定量检测中,ELISA 仍为主流技术;而 MS 法可用于特定蛋白(如高风险蛋白)的鉴定与定量,已成为重要的互补手段。此外,检测过程中所用试剂与耗材的质量,会直接影响检测结果的准确性。质量不达标的试剂,可能引发检测结果出现假阳性或假阴性。举例来说,若抗体的特异性与亲和力不足,可能在 ELISA 检测中产生交叉反应;若抗原代表性不足或抗体覆盖率偏低,则可能造成漏检;而稀释液抗干扰能力较弱时,也会对检测准确性产生影响。相关案例研究显示,采用定制化方法替代原有商业化试剂盒后,抗原代表性与抗体覆盖率明显提升,HCP 检测值也呈现整体升高的趋势。
通用型宿主细胞蛋白(HCP)残留检测方法对比SHENTEK® AutoElisa-4K HCP 检测自动化系统可减少人为误差,满足 21 CFR Part 11 数据管理要求。
宿主细胞蛋白(HCP)残留监测是生物药物生产中的关键质量属性(Critical Quality Attribute, CQA),需在药物开发与生产阶段对 HCP 的存在实施严格监控、管理及记录。随着生产流程推进,生物制品目标蛋白纯度逐步提升,HCP 含量则相应持续下降,这导致对单抗、融合蛋白等富含目标蛋白的下游工艺样品进行 HCP 分析监测时,难度明显增加。在此背景下,高效的 HCP 富集材料与技术显得尤为重要。SHENTEK®AbunProteoX 是基于磁珠构建的亲和配体,能高效识别并结合目标蛋白;借助磁性纳米颗粒的独特特性,它可快速高效捕获 HCP,大幅提升检测灵敏度。此外,该亲和配体的普遍适用性,让 AbunProteoX 处理多种生物样本时表现优异,可确保样品中存在高浓度目标蛋白时,对低浓度 HCP 的质谱、电泳等检测分析具备准确性与可靠性。
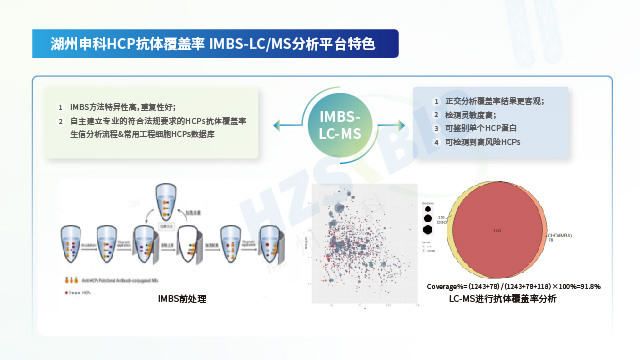
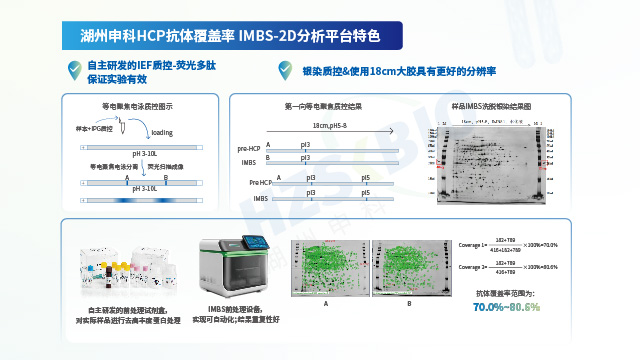
湖州申科生物凭借自主可控的供应链与经严格验证的技术性能,确保 HCP 检测试剂盒的长期稳定供应及出色分析能力。一方面,公司实现关键物料自研自产:校准品通过冻干工艺大规模生产,能稳定储存 10 年以上;抗体经大动物免疫制备,产量可支撑≥10,000 盒试剂盒生产,确保同批次抗体连续供应超 10 年;试剂盒经多批次验证,批内与批间一致性表现良好。另一方面,所有产品均参照 ICH Q2(R2)及 ICH M10 法规要求完成验证:以大肠杆菌(E.coli)HCP 产品为例,其线性范围(1-243 ng/mL)的 R²>0.999,各浓度点回收率偏差≤5%;准确度处于 81.2%-111.6% 区间,中间精密度 CV 值为 5.7%-12.4%;定量限(LLOQ)低至 1.5 ng/mL,且对 CHO、HEK293 等多种宿主细胞的交叉反应均低于检测限。同时,借助二维电泳(检出 826 个蛋白点)与质谱法(鉴定 2204 个蛋白点)对校准品进行双重表征,并运用 IMBS-2D(覆盖率 > 70%)与 IMBS-MS(覆盖率 84.7%)正交技术验证抗体覆盖率,从源头保障检测结果的全面性与可靠性。
湖州申科开发多种宿主 HCP 检测试剂盒,提供抗体覆盖率验证服务。
LC-MS/MS 作为成熟稳定的蛋白质组学分析技术,依托超高分辨率与准确度,在生物分析领域中占据关键地位。该技术不仅可对低含量宿主细胞残留蛋白(HCP)开展定性检测,还能通过构建专属蛋白质谱库准确鉴定 HCP 的具体种类,为深度解析残留蛋白组成提供重要支撑。不过该技术应用中面临的主要挑战,是如何优化 LC-MS 方法以契合 GMP 规范对产品放行检测的严苛要求。在质谱检测环节,引入表征明确的内标与外标蛋白,可准确分析 HCPs 的整体组成,并有效识别其中具有潜在风险的高风险蛋白。这一技术手段不仅为开发产品专属 HCP ELISA 检测方法提供有力数据支撑,还可助力工艺优化升级,加快推进生物制品从研发到获批上市的全流程进度。
宿主检测方法替换需桥接验证,确保新旧方法结果一致性与可比性。毕赤酵母宿主细胞蛋白(HCP)残留检测
湖州申科系列HCP检测产品均进行了校准品的表征分析,抗体覆盖率分析。北京通用型宿主细胞蛋白(HCP)残留检测方法开发
中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO)是生物制品生产中常用的动物细胞表达系统,广泛应用于抗体、重组蛋白、疫苗等产品的制备。采用 CHO 细胞作为宿主进行生产时,难免会引入宿主细胞蛋白(HCP)杂质;即便 HCP 残留量较低,仍可能存在免疫原性,还会带来降低产品蛋白稳定性等风险。因此,需对生物制品中的 HCP 残留进行定量分析,从而保障纯化工艺的一致性与终产品的安全性。SHENTEK®CHO 宿主细胞蛋白(HCP )残留检测试剂盒实现了关键试剂的全国产化,其通过 CHO 细胞(K1&S)补料分批培养工艺制备 HCPs,再以此免疫绵羊获取抗体,适用于检测 CHO 细胞系表达的生物制品(如单抗、重组蛋白、疫苗等)中的 HCP 残留。该试剂盒具有操作步骤少、检测速度快、专一性强、性能稳定可靠的特点。
北京通用型宿主细胞蛋白(HCP)残留检测方法开发