在內毒素检测的技术体系中,凝胶法与动态显色法基于不同原理与特性,形成互补应用格局。凝胶法依托鲎试剂与内毒素的凝集反应,实现定性或半定量检测,其灵敏度覆盖 0.03EU/ml、0.06EU/ml 等多梯度,60 分钟即可完成反应;检测结果依赖肉眼观察(180° 倒转判读凝胶形成),数据需手工记录,配套 内毒素凝胶法测定仪(恒温仪) 即可开展,虽自动化程度有限,但操作简洁,适用于生产环节的快速初筛。与之相比,动态显色法通过监测反应混合物吸光度或透光率的变化(如达预设检测值的反应时间、信号增速)实现 定量检测 ,灵敏度拓展至 5-0.005EU/ml ,60-90 分钟反应时长虽略长,却可借助酶标仪或全自动内毒素检测分析仪完成全流程自动化操作—软件实时采集数据,契合药品生产质量管理规范(GMP)对数据追溯与精度的要求。二者各有侧重:凝胶法以 “快速定性” 服务基础防控,动态显色法凭 “准确定量 + 自动化” 支撑严苛质控,共同为內毒素检测提供灵活适配的技术路径。
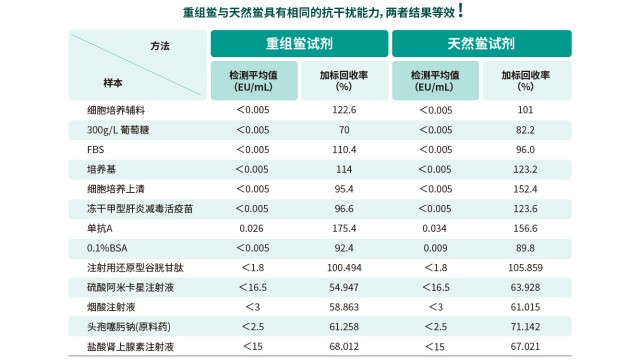
70% 葡萄糖等高渗溶液会使鲎试剂蛋白变性,检测前需用检查用水稀释样本。江苏抗体药物内毒素检测抗干扰方案
鲎试验法(LAL 法)是细菌内毒素检测的经典方法,依据反应监测方式可分为三类:凝胶法、浊度法和显色法。凝胶法通过观察是否形成凝胶判断内毒素是否超标,其优势是操作简便、成本较低,适用于定性或半定量检测,如医疗器械初筛;浊度法通过监测反应体系浊度变化速率定量内毒素,灵敏度高(可达 0.005 EU/mL),适用于生物制品原液等高精度需求场景;显色法基于显色底物的吸光度变化定量,抗干扰能力较强,适配复杂基质样品(如含蛋白质的注射液)。三种方法均需严格控制反应温度(37℃±1℃)和时间,确保结果可靠性。
血液制品内毒素检测LER现象细菌内毒素是革兰氏阴性菌细胞壁脂多糖,细菌死亡裂解释放,微量级即致人体发热、休克等威胁。
内毒素检测常与热原检测混淆,二者既有关联又有区别:热原是指所有能引起发热的物质(包括内毒素、病毒、真菌等),通过传统家兔热原试验检测;内毒素是热原的主要成分(占 90% 以上),检测更具特异性。目前,家兔热原试验因操作复杂、动物成本高,已逐渐被单核细胞活化反应测定法(MAT)替代,但部分产品(如放射性质药物、血液制品)仍需保留家兔试验作为补充。法规要求内毒素检测结果需与热原风险关联,若内毒素检测合格但临床出现热原反应,需排查是否存在非内毒素类热原,通过联合检测确保产品安全性。
当实验室更换内毒素检测方法或更换试剂供应商时,需进行方法比对与桥接验证。比对实验需选取至少 3批代表性样品,分别用新旧方法检测,计算结果相关性(如相关系数 R²≥0.95)和偏差(≤20%)。桥接验证还需评估新方法的特异性、灵敏度是否与旧方法一致,如确认对高风险样品(如含 β- 葡聚糖的样品)的抗干扰能力相当。若方法变更涉及法规申报产品,需将验证数据纳入申报资料,证明变更后方法仍能有效控制内毒素风险,符合 FDA、NMPA 等监管机构对方法变更的合规性要求。
样本含内毒素结合物时,可尝试用分散剂减少抑制,保障内毒素正常检出。
内毒素检测方法验证需覆盖多项参数,确保方法可靠:线性范围需包含样品预期浓度(如 0.01-10 EU/mL),相关系数 R²≥0.98;准确度通过加标回收率评估,应在 50%-200% 范围内;精密度包括批内和批间精密度,CV 值均应≤15%;检测限(LOD)需低于产品限值的 1/2(如限值 0.5 EU/mL,LOD 应≤0.25 EU/mL);专属性需证明无干扰物质影响(如 β- 葡聚糖、蛋白质不引发假阳性)。验证通过后,方法需经实验室负责人批准方可使用,且定期需进行一次回顾性验证,确认方法持续有效。
表面活性剂会改变内毒素活性,用重组级联试剂检测前需稀释样本,消除其对反应的干扰。广东原料药内毒素检测抗干扰方案
针对特殊样本,rCR 在细菌内毒素检测中的不干扰稀释倍数(NID)比重组C因子(rFC)更低。江苏抗体药物内毒素检测抗干扰方案
重组级联试剂(rCR)通过完整模拟天然鲎试剂的酶促级联反应路径,实现高效且特异的内毒素检测。其反应机制为:内毒素首先活化重组 C 因子,活化的 C 因子进一步活化重组 B 因子,随后活化重组凝固酶原转化为凝固酶,再催化显色底物产生黄色信号(405nm 波长可检测)。这一级联放大过程有效提升了检测灵敏度,即使微量内毒素也能产生可识别信号。与单因子的重组 C 因子法(rFC)相比,rCR 的多因子级联反应抗干扰能力更强,尤其对复杂基质样品(如高蛋白单抗、疫苗)表现更优。同时,rCR 剔除了天然鲎试剂中的 G 因子,避免了与 β-D 葡聚糖的非特异性反应,从根本上减少假阳性结果,保障检测数据的可靠性。
江苏抗体药物内毒素检测抗干扰方案