当实验室更换内毒素检测方法或更换试剂供应商时,需进行方法比对与桥接验证。比对实验需选取至少 3批代表性样品,分别用新旧方法检测,计算结果相关性(如相关系数 R²≥0.95)和偏差(≤20%)。桥接验证还需评估新方法的特异性、灵敏度是否与旧方法一致,如确认对高风险样品(如含 β- 葡聚糖的样品)的抗干扰能力相当。若方法变更涉及法规申报产品,需将验证数据纳入申报资料,证明变更后方法仍能有效控制内毒素风险,符合 FDA、NMPA 等监管机构对方法变更的合规性要求。
动态显色法鲎试剂监测吸光度变化定量内毒素,抗干扰强,适配复杂基质样品检测。上海原料药内毒素检测方法验证
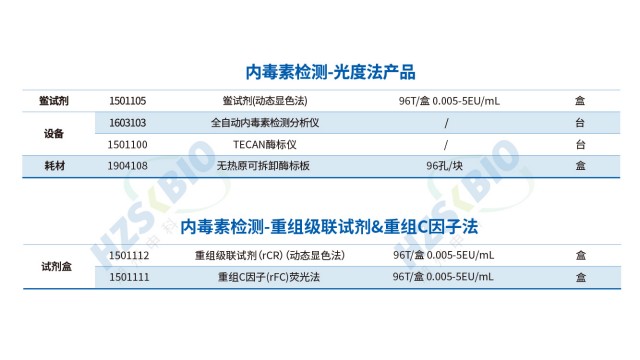
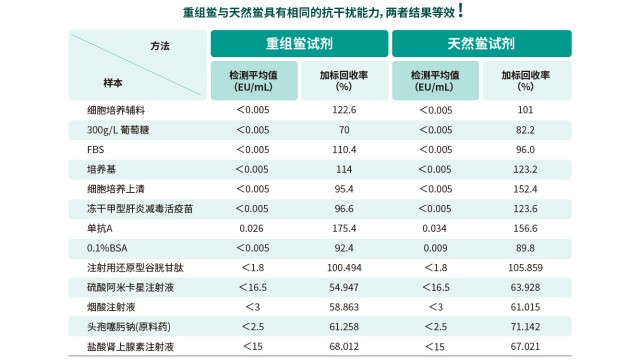
内毒素检测重组级联试剂(rCR)在方法桥接方面具有明显优势,可大幅度降低实验室的转换成本。在设备兼容性上,rCR 无需额外采购新设备,完全适配天然鲎动态显色法现用的酶标仪(如 Molecular Devices、Tecan sunrise、Thermo MultiSkan ET 等品牌),支持 405nm 波长动态读数和 37℃恒温孵育。操作流程上,rCR 的样品处理、试剂混合、加样孵育等步骤与天然鲎试剂一致,实验室无需重新培训操作人员或修改 SOP。显色系统方面,rCR 沿用与天然试剂相同的 PNA 显色底物,通过黄色信号变化定量,检测原理和数据分析方法保持不变。这种高度兼容性使实验室能快速完成方法验证和切换,加速重组试剂的合规应用进程。
北京化学制药内毒素检测结果判定含蛋白酶的样本致假阳性时,可稀释后 70℃加热 5-15min 灭活,再做内毒素检测。
生物制品(如单抗、疫苗、重组蛋白)注射剂因直接进入人体,对细菌内毒素残留限值要求严苛(通常≤0.5 EU/mg 或更低),检测面临基质复杂、干扰物质多等挑战。样品中常见的蛋白质、螯合剂、表面活性剂等可能抑制或增强 LAL 反应,需通过预处理消除干扰:如采用稀释法降低基质浓度、添加中和剂(如 Mg²⁺)修复反应体系,或使用热灭活去除蛋白类干扰物。此外,生物制品生产全流程需进行内毒素监控,从细胞培养上清、纯化中间品到终产品均需检测,确保工艺去除内毒素的有效性,符合 ICH Q6B 等法规对 “关键质量属性” 的控制要求。
医疗器械(如输液器、注射器、植入式设备)若携带内毒素,可能通过血液、组织接触引发异常反应或炎症反应。其检测需遵循 “模拟临床使用” 原则:采用浸提液(如 0.9% 氯化钠溶液或注射用水)在 37℃±1℃下浸提器械表面内毒素,再通过 LAL 或 rFC 法检测浸提液。不同器械的内毒素限值差异明显:一次性输液器需≤0.5 EU/device,植入式心脏瓣膜则要求更严格(≤0.06 EU/device)。检测时需注意器械材质对浸提效率的影响,如塑料类器械可能吸附内毒素,需优化浸提时间(通常≥1 小时)或采用超声辅助提取,确保残留内毒素被充分检出。
湖州申科凝胶法鲎试剂符合药典要求,配抗增液抑制非特异性反应,多灵敏度可选。
内毒素检测方法验证需覆盖多项参数,确保方法可靠:线性范围需包含样品预期浓度(如 0.01-10 EU/mL),相关系数 R²≥0.98;准确度通过加标回收率评估,应在 50%-200% 范围内;精密度包括批内和批间精密度,CV 值均应≤15%;检测限(LOD)需低于产品限值的 1/2(如限值 0.5 EU/mL,LOD 应≤0.25 EU/mL);专属性需证明无干扰物质影响(如 β- 葡聚糖、蛋白质不引发假阳性)。验证通过后,方法需经实验室负责人批准方可使用,且定期需进行一次回顾性验证,确认方法持续有效。
细菌内毒素是革兰氏阴性菌细胞壁脂多糖,细菌死亡裂解释放,微量级即致人体发热、休克等威胁。江苏医疗器械内毒素检测常见问题分析
细菌内毒素检测中,rCR 加标回收率稳定在 50%-200% 药典范围,可准确完成检测。上海原料药内毒素检测方法验证
湖州申科针对 LER 提供多平台内毒素检测解决方案,适配不同成因的 LER 问题:一是鲎试剂配套增强剂,通过添加分散剂、过量二价阳离子,改善 LPS 聚集体状态,提升回收率;二是重组鲎试剂(rCR),无 G 因子干扰,完全模拟天然鲎级联反应,灵敏度达 0.005EU/mL,易与天然方法桥接;三是重组 C 因子(rFC),灵敏度 0.005-5EU/mL,性状稳定,适配特定基质;四是 单核细胞活化反应测定(MAT)法,通过检测 IL-6 覆盖全热原,不受 LPS 结构变化影响;五是质谱技术,验证基质残留对检测的干扰。多平台协同确保内毒素检测准确可靠。
上海原料药内毒素检测方法验证