临床前动物实验的标准操作规程以及实验计划和实验方案制定:医疗器械的安全性评估通常基于所提供有效科学证据的动物实验研究,应具有适当的标准操作规程,以确保数据的质量和完整性。研究机构应当制定与其业务相适应的标准操作规程。关于需要制定的标准操作规程可参考《药物非临床研究质量管理规范》第七章的合计15项条款。建议临床前动物实验研究包括适当的控制措施以尽量减少实验的变异性和差错。这样的措施包括但不限于在试验过程中尽量减少影响实验动物的因素。生物药临床前动物实验指标;重庆专业临床前动物实验评价
当临床前动物实验结果显示化合物具有足够的安全性并准备进入人体试验时主办者需要向FDA申请新药临床试验investigationalNewDrugApplication,ND申请)。按照美国食品、药品和化妆品法案(Food,DrugandCosmeticAct),此时的化合物已经成为研究药物,将受到官方的监管。FDA收到药物申报主办者递交的IND时,药物申报主办者,即负责药物上市的公司硏究机构和其他组织,必须向FDA提供其对实验动物所进行临床前试验的结果,以及进行人体试验的具体计划。在这个阶段,FDA必须判断药物是否安全,是否达到实施人体试验的标准。化学药临床前动物实验研究本研究采用临床前动物实验验证效果。

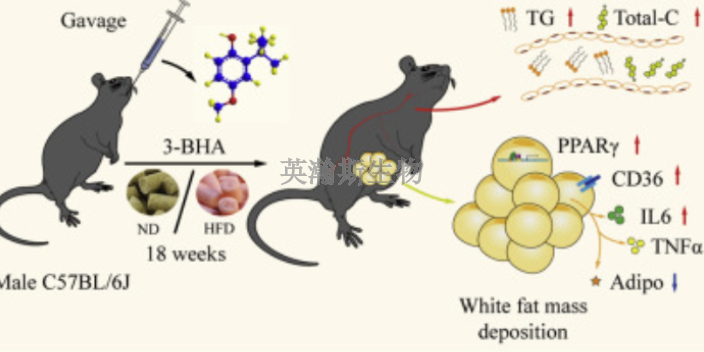
临床前动物实验由于现代科学技术的进步,疫苗抗原制备的速度可以很快。就**疫苗而言,全世界的研究者都得益于中国科学院武汉病毒研究所的基因序列公布。张改平说,我们追求的是安全、高效、不浪费免疫潜力的疫苗,在进行了临床前动物实验的前提下,力争把特定疫苗做到它现代科学技术条件下的比较高境界。所谓免疫潜力,作为生理潜力的组成部分,人、动物都非常强大。在正常情况下,这些能力是用于生长、抗逆、工作、学习和生产(就动物而言)等的,若一个疫苗而过多使用(抗原不够高效、免疫次数多、免疫剂量大等),就会影响其它方面,同时也因机体免疫系统承受压力过大而免疫保护效果欠佳。浪费免疫潜力的情况以往没有被高度重视。
临床前动物实验是评价医疗器械安全性和有效性研究中的重要手段之一,其属于产品设计开发中的重要研究,可为产品设计定型提供相应的证据支持;若需开展临床试验,可为医疗器械能否用于人体研究提供支持,降低临床试验受试者及使用者的风险以及为临床试验设计提供参考。然而,并不是所有医疗器械都需要通过动物实验来验证产品安全性和有效性。2019年4月18日,为加强医疗器械产品注册工作的监督和指导,进一步提高医疗器械注册审查质量,国家药品监督管理局组织制定了《医疗器械动物实验研究技术审查指导原则初次部分:决策原则》。这是开展动物实验判定路径依据,具有里程碑的意义。这是国家药监部门初次发布关于动物实验的官方文件,结束了医疗器械动物实验长期无规可循的局面。2019年11月27日,为了进一步规范医疗器械动物实验研究,医疗器械技术审评中心组织起草了《医疗器械动物实验研究技术审查指导原则第二部分:实验设计、实施质量保证(征求意见稿)》,该原则为医疗器械动物实验研究技术审查指导原则系列中的第二部分,申请人可参照该指导原则开展动物实验设计、实施与质量保证相关工作,将进一步指导申请人在适当负担下更高质量地开展医疗器械动物实验研究。中成药临床前动物实验哪家好?
作为**个可植入的、第三代心室辅助装置——磁液双悬浮血泵“火箭心”,已经进入批量生产的临床前动物实验期。目前进行的动物实验主要是观察血泵的血液动力学参数、生物相容性以及对动物身体的影响情况。下一步将开展生物医学和工程学检测。完成至少6批次的动物实验后,即可进入临床试用阶段。慢性心力衰竭是心血管病中比较常见而且危害比较大的疾病之一,目前我国有1600多万心衰患者。目前对于心衰的***,一般采取药物***、外科手术、机械辅助循环及心脏移植。动物实验的伦理问题在临床前动物实验中被越来越多地关注。山东值得信赖临床前动物实验外包
临床前动物实验是新药研发过程中不可或缺的一部分。重庆专业临床前动物实验评价
医疗器械安全性和有效性评价中动物试验是重要手段之一,医疗器械临床前动物试验研究是许多Ⅲ类医疗器械,特别是创新型医疗器械进行临床试验研究之前需要开展的重要项目。本综述为规范开展医疗器械临床前动物试验研究提供参考。方法:本文在归纳国内外医疗器械临床前动物试验研究领域的法规、标准的基础上,参考了《药物非临床研究质量管理规范》的框架对医疗器械临床前动物试验研究的考虑要点进行了归纳整理。结果:本文从人员、设施、仪器设备和实验材料、试验系统、标准操作规程、研究工作的实施、总结报告以及质量保证和资料档案等几个方面,归纳总结了医疗器械临床前动物试验研究的考虑要点。结论:本文为医疗器械临床前动物试验研究提供更普遍的理解,为开展动物试验研究提供参考。重庆专业临床前动物实验评价