- 品牌
- RHLIMS
- 型号
- 定制化
药品留样管理直接关系着质量争议的法律举证能力。某仿制药企曾因留样室温湿度记录缺失,在FDA现场检查中收到483缺陷项。LIMS系统建立的智能留样库,采用超高频RFID通道门技术,实现进出库样品的毫秒级自动登记。系统内置的ICHQ7合规模型,能根据样品特性(光敏感/吸湿性)自动计算较小留样量,并关联稳定性研究数据推荐保存条件。某原料药生产商应用后,留样柜空间利用率提升65%。销毁环节引入量子云链技术,每个留样瓶植入NFC芯片,销毁时需三级授权人现场扫码确认,操作过程全程北斗定位追踪。某疫苗生产企业通过该模块,成功追溯某批次冷链异常样本,避免。针对临床试验样本,系统创新开发"虚拟留样"功能,将实物样本转化为数字孪生体,通过3D扫描和光谱特征存档,某CRO公司借此将样本存储成本降低42%。所有留样数据自动生成符合EUGMPAnnex11要求的电子档案,支持欧盟FMD法规要求的序列化追溯。 电子签名确保操作可追溯。器材管理样品管理标准
LIMS 系统的样品数据统计分析为管理决策提供有力支持。系统可自动汇总样品管理的各项指标,生成多维度报表,如月度样品接收量统计、各检测项目样品占比分析、样品平均周转时间趋势图等。通过这些报表,管理人员能清晰掌握实验室的样品处理能力和效率瓶颈,例如发现环境类样品的平均检测周期长达 7 天,远超其他类型样品,可针对性优化检测流程或增加设备投入。此外,系统支持自定义报表功能,操作人员可根据需求选择统计维度和展示方式,如按送检单位分析样品不合格率,为客户服务改进提供数据参考。医疗实验室应用样品管理作用样品保留期限依项目规定执行,保留期满后,按程序审批并合规处置,避免环境污染与资源浪费。
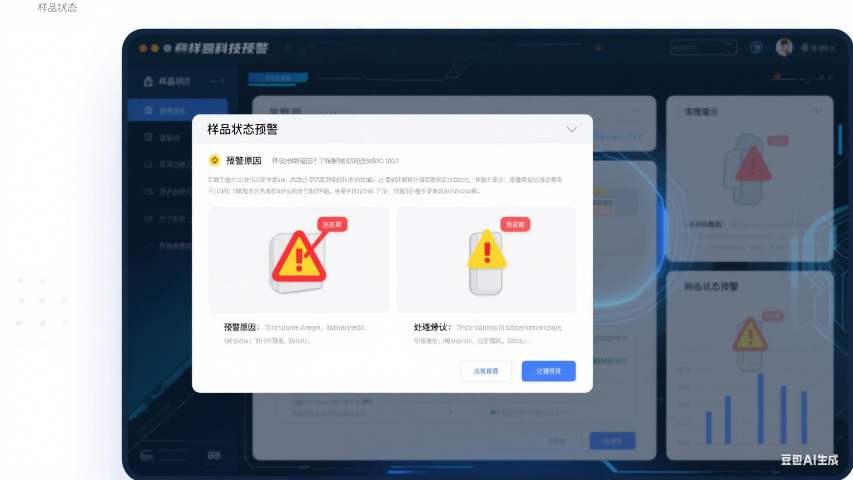
在药品溶出度检测中,分样精度直接影响实验结果有效性。LIMS系统通过与梅特勒托利多天平的RS232直连,实现称量数据毫秒级抓取,自动生成带不确定度计算的电子记录。某药企QC实验室应用后,分样偏差从±1.5%缩小至±0.3%。系统内置的增强现实分样指引,可通过智能眼镜投射标准操作画面,确保新人操作合格率首周即达95%。对于需要冷冻研磨的特殊样品,系统可基于材料特性(如橡胶弹性模量)自动计算合适的研磨参数,某高分子材料实验室因此将制样时间缩短40%。所有分样操作均需通过生物识别认证,配合视频追溯系统,实现"每个动作可审计"的质量管控。
样品管理中的批次管理功能在 LIMS 系统中具有重要意义。对于同一批次的样品,系统会赋予统一的批次编号,将该批次下的所有子样品关联起来,便于进行批量操作和数据统计。例如,某批次的食品样品在检测中发现微生物超标,通过批次管理可快速定位该批次所有样品的存储位置和检测状态,及时采取隔离措施。同时,系统支持按批次查询检测结果,分析批次内样品的质量稳定性,为生产工艺改进提供依据。
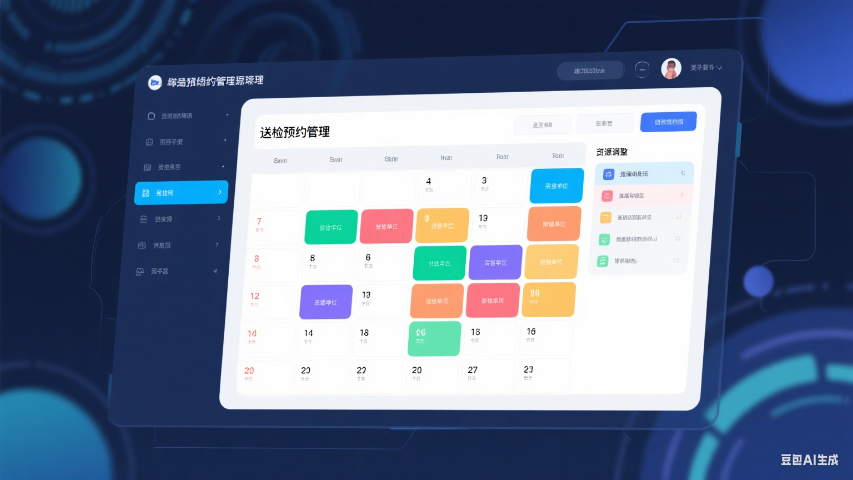
LIMS 系统的样品预约管理优化了实验室的工作安排。送检方可通过系统提前预约样品送检时间、检测项目和数量,实验室管理人员根据预约信息合理调配资源,如安排检测人员、准备试剂和设备。系统会向送检方发送预约确认通知,包括样品接收地点和所需提交的资料,减少现场等待时间。对于超出实验室承接能力的预约,系统会及时反馈并建议调整时间,避免资源重叠,提高实验室的运营效率。 检测任务看板动态展示人员工作负荷,任务分配更均衡。

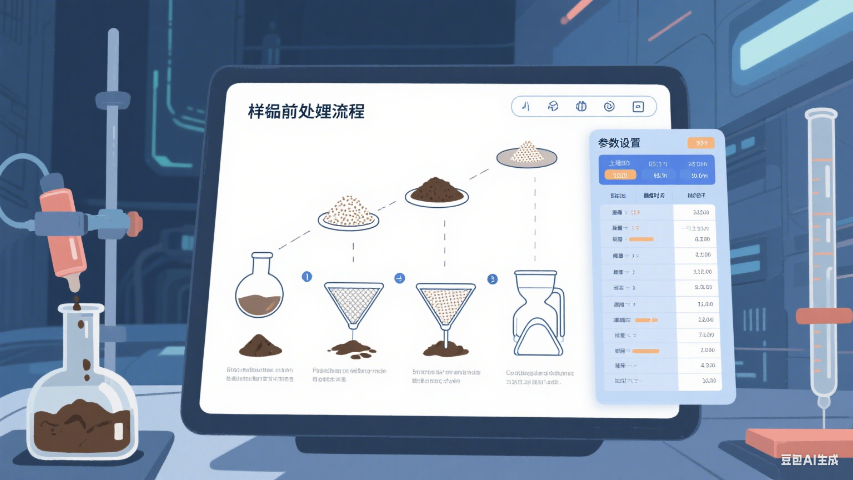
样品前处理管理是 LIMS 系统确保检测准确性的重要环节。系统会根据样品类型和检测项目,自动推荐标准的前处理流程,如土壤样品需经过风干、研磨、过筛等步骤,水质样品可能需要离心、萃取等操作。操作人员需在系统中记录前处理的具体参数,如研磨时间、萃取剂用量、离心转速等,这些数据会与样品信息绑定,形成完整的检测溯源链。若前处理过程中出现异常,如试剂用量偏差,系统会提示操作人员进行确认或重新操作,避免因前处理不当影响检测结果。环境样品GPS定位数据自动关联LIMS记录,确保采样点真实性。器材管理样品管理标准
生物制药企业应用LIMS后样品交叉污染率降低至0.02%。器材管理样品管理标准
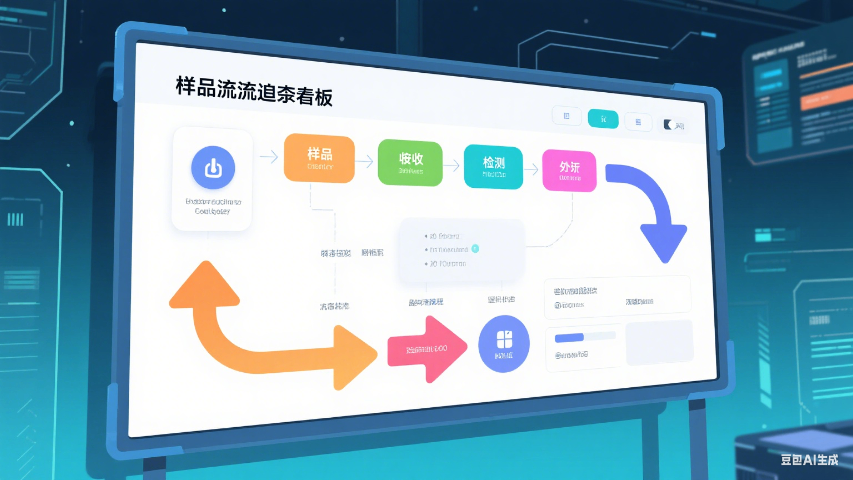
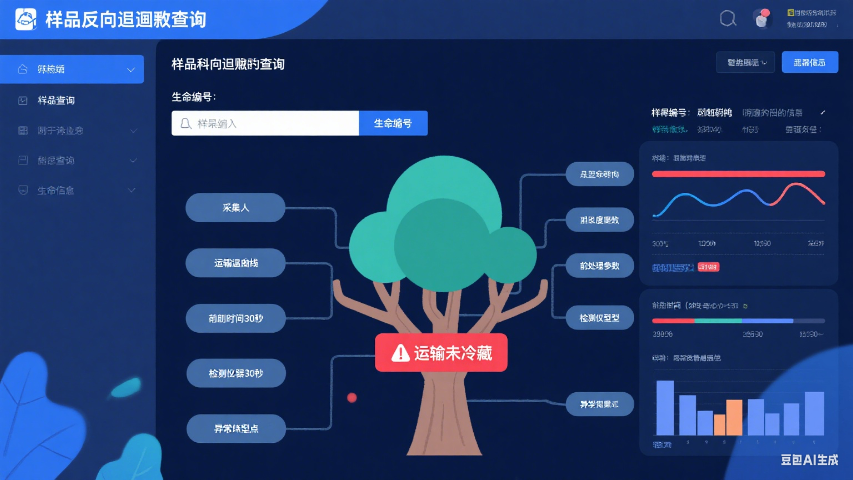
LIMS系统的样品管理模块通过数字化手段覆盖样品从登记、接收、检测到存储和处置的全生命周期管理,彻底解决了传统实验室依赖纸质记录导致的效率低下与信息孤岛问题。系统动态记录样品的到达时间、状态变化(如“待检测”“已分样”)、检测进度(如仪器分配、结果录入)以及存储位置更新等关键节点,确保每个操作环节均可追溯。例如,在食品检测实验室中,系统可实时追踪样品的检测进度,若某批次样品因设备故障导致延误,管理人员可通过时间轴功能快速定位问题环节并启动应急预案。此外,LIMS支持生成符合ISO/IEC 17025、GMP等标准的审计日志,自动记录操作人员、时间戳及修改历史,为实验室通过CNAS、CMA等认证提供数据支撑816。研究表明,采用LIMS后,实验室样品追溯效率提升60%,人为操作失误率降低45%器材管理样品管理标准
样品前处理管理是 LIMS 系统确保检测准确性的重要环节。系统会根据样品类型和检测项目,自动推荐标准的前处理流程,如土壤样品需经过风干、研磨、过筛等步骤,水质样品可能需要离心、萃取等操作。操作人员需在系统中记录前处理的具体参数,如研磨时间、萃取剂用量、离心转速等,这些数据会与样品信息绑定,形成完整的检测溯源链。若前处理过程中出现异常,如试剂用量偏差,系统会提示操作人员进行确认或重新操作,避免因前处理不当影响检测结果。检测进度看板实时显示各环节耗时,瓶颈环节识别效率提升60%。实验流程优化样品管理有什么LIMS系统内置的合规性引擎通过实时规则校验,确保样品管理全流程符合国内外法规要求。例如,在医...
- 样本跟踪样品管理对比价 2026-02-13
- 基础科学研究样品管理要求 2026-02-11
- 医疗实验室应用样品管理有什么 2026-02-10
- 基础科学研究样品管理在实验室中发挥的作用 2026-02-10
- 水质检测样品管理参考价 2026-02-09
- 实验流程优化样品管理软件 2026-02-07
- Saas版样品管理值多少钱 2026-02-06
- 医疗实验室应用样品管理咨询问价 2026-02-05
- 实验流程优化样品管理比较价格 2026-02-04
- 环境科学和监测样品管理开发 2026-02-04
- 如何选择样品管理大概价格 2026-01-22
- 高校样品管理分析 2026-01-20
- 人员管理样品管理软件开发 2026-01-20
- 什么样品管理包含哪些模块 2026-01-19
- 食品饮料样品管理供应 2026-01-17
- 食品饮料样品管理解决方案 2026-01-16


- 什么是质量管理价目 02-13
- 样本跟踪样品管理对比价 02-13
- 如何选择数据准确性优势 02-13
- 如何选择设备仪器管理优势 02-12
- 数据设备仪器管理介绍 02-12
- 生产智造数据管理软件公司 02-12
- 资源管理设备仪器管理作用 02-12
- 数字数据准确性对比价 02-12
- 3C检测数据准确性参考价 02-12
- 定制化服务设备仪器管理客服电话 02-11