- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
细胞转染实验简介实验步骤:1、细胞传代(1)试验准备:200ul/1mlTip头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。(2)弃掉培养皿中的培养基,用1ml的PBS溶液洗涤两次。(3)用Tip头加入1mlTrypsin液,消化1分钟(37。C,5%CO2)。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。(4)加入1ml的含血清培养基终止反应。(5)用头多次吹吸,使细胞完全分散开。(6)将培养液装入离心管中,1000rpm离心5min。(7)用培养液重悬细胞,细胞计数后选择0.8X106个细胞加入一个35mm培养皿。(8)将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。(9)将培养皿转入CO2培养箱中培养,第二天转染。有血清时的转染 血清一度曾被认为会降低转染效率。昆明细胞高效转染试剂厂家推荐

细胞转染效率低下的几个大坑:1. 细胞污染细胞污染也是造成细胞死亡,转染效率低下的一大原因。首先,转染细胞用的质粒必须保证无菌。而现在市场上的一般的质粒提取试剂盒都做不到较全无菌。毛博这里再贡献一个独门绝招:将提完质粒后或者提的较后一步,用75%乙醇沉淀,这样就除菌了。2.质粒不行转染用的质粒首先要保证数量,一般为2 μg以上。质粒纯度不够或者含有细菌LPS或其他对细胞有毒害作用的物质,也会影响转染效率。这个时候,就应该对质粒进行纯化和浓缩。合肥正规细胞高效转染试剂阳离子脂质体转染试剂脂质转染试剂,以其适用宿主范围广。

如何提高细胞转染实验效率:优化细胞生长状态密切观察您的细胞;确保它们状态良好。在开始转染细胞之前,先制定一个适当的种板方案,使细胞密度从转染开始到结束都保持较佳状态。增加成功几率—细胞是转染过程中的一个关键元素,它可以是影响结果的一致性和质量的较重要的变量。此外,还常用促有丝分裂刺激物(如,细菌转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。贴壁细胞相比较悬浮细胞—在转染效率方面贴壁细胞和悬浮细胞之间的差异明显。天生趋于悬浮的细胞(如HL 60,Jurkat)非常难以转染。相反,天生为贴壁的细胞(如HEK,CHO)则可适应悬浮生长的条件。
影响转染试验的因素:1.转染试剂跟细胞系不匹配转染试剂跟细胞系也是讲究配合默契的,使用同一种试剂,不同细胞系转染效率通常不同。但细胞系的选择通常是根据实验的需要,因此在转染实验前应根据实验要求和细胞特性选择适合的转染试剂。每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料可选择较适合实验设计的转染试剂。当然,较适合的是高效、低毒、方便、廉价的转染试剂。因为有些细胞系是不稳定的,可能随着培养时间的改变,培养条件的不同,不同的选择压力,可能引起不同的克隆选择。因此就算是同一个细胞系,在不同条件下转染能力的差异可能会很大。细胞密度以及转染的时间长短和培养基中血清的含量都是影响转染效率的重要因素。

细胞转染的注意事项:物品(PS)物品,比如青霉素和链霉素,是影响转染的培养基添加物。这些物品一般对于真核细胞无毒,但阳离子脂质体试剂增加了细胞的通透性,使物品可以进入细胞。这降低了细胞的活性,导致转染效率低。所以,在转染培养基中不能使用物品,甚至在准备转染前进行细胞铺板时也要避免使用物品。这样,在转染前也不必润洗细胞。对于稳定转染,不要在选择性培养基中使用青霉素和链霉素,ICIN选择性物品的竞争性克制剂。另外,为了保证无血清培养基中细胞的健康生长,使用比含血清培养基更少的物品量。震荡后将试剂放在-20摄氏度保存,使用前还需震荡。郑州正规细胞高效转染试剂服务电话
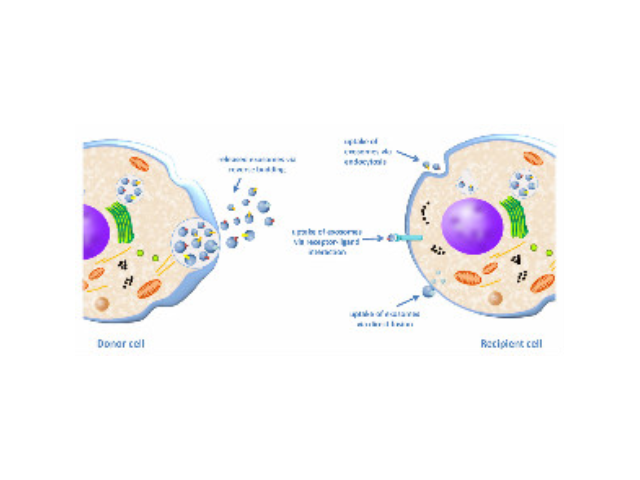
*有一部分转入细胞的DNA被转运到细胞核内进行转录并较终输出mRNA到细胞质进行蛋白合成。昆明细胞高效转染试剂厂家推荐
细胞转染那些事儿:1.设置阴性和阳性对照:一般在转染后24-48h,靶基因即在细胞内表达。可依据不同的实验目的,24-48h后即可进行靶基因表达的检测等实验。2.转染后效率的检测方法:观察转染后细胞荧光情况;qPCR验证;WB检测敲减或过表达蛋白。3. 转染效率低,可采取以下两种方法:1 )复转染,即转染后12-24h再进行转染,前提是该细胞对脂质体的耐受性较好,转染后细胞死亡数较少。2 )通过药筛来杀死未转入成功的细胞,前提是该质粒带有物品抗性的基因。4. 电转时,不同的细胞需要的电压是不一样的,需要做预实验,摸索较佳条件。对于大多数细胞而言,较佳电压位于250-1250v/cm。电击后,应该将DNA和细胞混合液在室温下放置10min,使细胞恢复损伤。昆明细胞高效转染试剂厂家推荐
影响转染试验的因素:细胞状态变化:(1)转染试剂与细胞不匹配细胞转染较适合的不是原代细胞,也不是传代很多次的细胞。这是因为细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。较适合转染的细胞是经过几次传代后达到对数生长期的细胞,细胞生长旺盛,较容易转染。(2)把握时机没错!转染也有适当的时机,相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。因此对大多数转染操作而言,细胞都在转染当天或前现在种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态,如细胞数量过多,互相叠加,营养物质耗竭,代谢废物积聚,转...
- 厦门细胞高效转染试剂厂家供应 2026-02-09
- 昆明正规细胞高效转染试剂厂家直销 2026-02-08
- 青岛正规细胞高效转染试剂厂家批发价 2026-02-08
- 成都正规细胞高效转染试剂厂家推荐 2026-02-08
- 昆明正规细胞高效转染试剂供应商 2026-02-08
- 贵阳正规细胞高效转染试剂 2026-02-07
- 无锡细胞高效转染试剂厂家批发价 2026-02-07
- 成都细胞高效转染试剂哪家好 2026-02-07
- 昆明正规细胞高效转染试剂进货价 2026-02-07
- 昆明细胞高效转染试剂哪家好 2026-02-07
- 石家庄正规细胞高效转染试剂单价 2026-02-06
- 南京细胞高效转染试剂服务电话 2026-02-06
- 温州正规细胞高效转染试剂价格 2026-02-06
- 宁波细胞高效转染试剂价格 2026-02-06
- 唐山细胞高效转染试剂直销厂家 2026-02-06
- 济南正规细胞高效转染试剂哪里买 2026-02-06


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14