- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
多泡内体的腔内囊泡,要么分选进溶酶体将物质降解,要么作为外泌体分泌到胞外环境中。将膜分选到不同的腔内囊泡群中的机制尚不清楚。该研究发现物质被分选到内体膜上的不同子域中,并且外泌体相关结构域向内体腔的转移不取决于ESCRT(运输所需的内体分选复合体)的功能,但是需要鞘脂神经酰胺。纯化的外体富含神经酰胺,并且在神经鞘磷脂酶被压制后外泌体释放减少。这些结果确定了内体内膜运输和外泌体形成的途径。环-GMP-AMP合酶(cGAS)在细菌传染期间检测胞质DNA并诱导抗细菌状态。cGAS信号通过合成第二信使——环GMP-AMP(cGAMP),启动干扰素基因的刺激物(STING)。该研究表明,当它们在cGAS表达细胞中产生时,cGAMP被整合到细菌颗粒中,包括慢细菌和疱疹细菌颗粒。细菌体将cGAMP转移至新传染的细胞并引发STING依赖性抗细菌程序。这些效应**于外泌体和细菌核酸。研究结果揭示了天然免疫信号在细胞间转移的途径,可能加速和扩大抗细菌反应。此外,用装载cGAMP的慢细菌传染树突细胞增强了它们的活化。因此,用cGAMP加载细菌载体对于疫苗开发具有很大希望。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。珠海外泌体提取试剂单价

外泌体作为RNAi药物载体的疗效:这项研究,检测了利用exosomes作为RNAi靶向药物的效果,并证明了这个过程中exosomes进行免疫逃逸的机制:对exosomes进行基因修饰(命名为iExosome),装载上靶向胰腺病细胞KRAS突变基因的RNA干扰药物,在小鼠模型上进行试验,结果表明,iExosome比同样经过修饰的脂质iLiposome递送效果更好,能够压制侵袭性胰腺病生长;这得益于exosomes表面的CD47,它能够阻止exosomes在血液循环系统中被单核细胞清理。这项研究结果对致力于exosomes转化医学的科学家来说,可谓振奋人心!合肥外泌体提取试剂厂家推荐逐渐取代超速离心法并推广开来。有些试剂盒操作简便,不用超速离心。
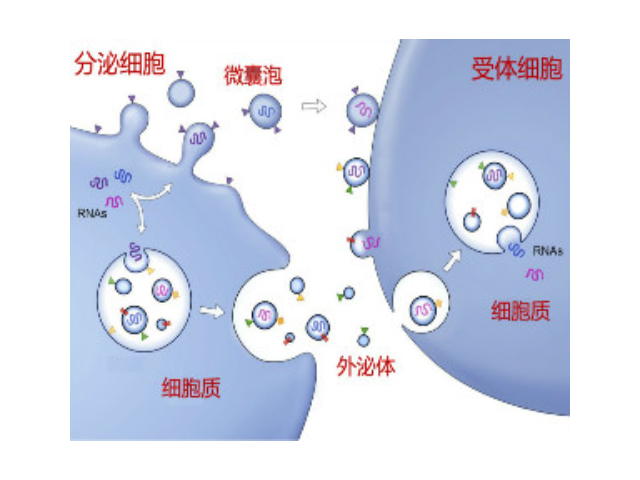
外泌体的组成:外泌体主要含有融合蛋白和转运蛋白、热休克蛋白(HSP70)、CD类蛋白以及磷脂酶和其他脂质相关蛋白,但是不同来源的外泌体的组成有差异。外泌体的提取方式:1、离心法:此种方法得到的外泌体量多,但是纯度不足。2、过滤离心:这种操作简单、省时,不影响外泌体的生物活性,但同样纯度不足。3、密度梯度离心法:用此种方法分离到的外泌体纯度较高,但是前期准备工作繁杂。4、免疫磁珠法:这种方法可以保证外泌体形态的完整,特异性高、操作简单,但生理性盐浓度会影响外泌体生物活性。5、色谱法:此种方法分离出的外泌体大小均一,但设备特殊,应用不普遍。
外泌体的提取的方式:1、免疫磁珠法,这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备,但是非中性pH和非生理性盐浓度会影响外泌体生物活性,不便进行下一步的实验。2、PS亲和法,该方法将PS(磷脂酰丝氨酸)与磁珠结合,利用亲和原理捕获外泌体囊泡外的PS。该方法与免疫磁珠法相似,获得的外泌体形态完整,纯度较高。由于不使用变性剂,不影响外泌体的生物活性,外泌体可用于细胞共培养和体内注射。2016.9《ScientificReports》杂志发表了该方法较新数据,表明PS法可提取相当高纯度的外泌体。六是色谱法,这种方法分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。外泌体(Exosome)是从体液(尿液、血液、唾液、腹水、胸腹水等)和细胞液中快速提取的。
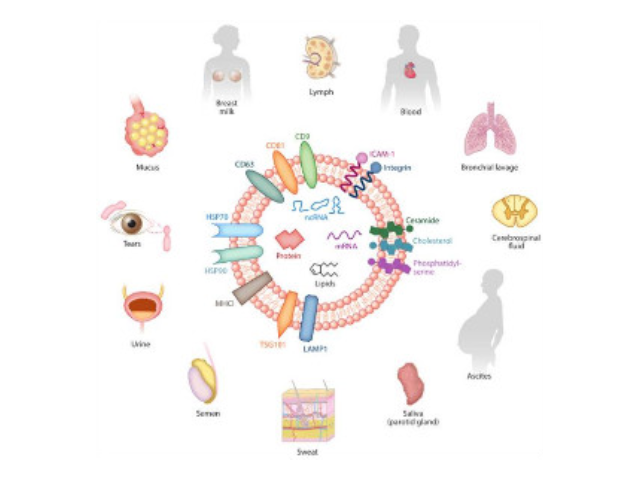
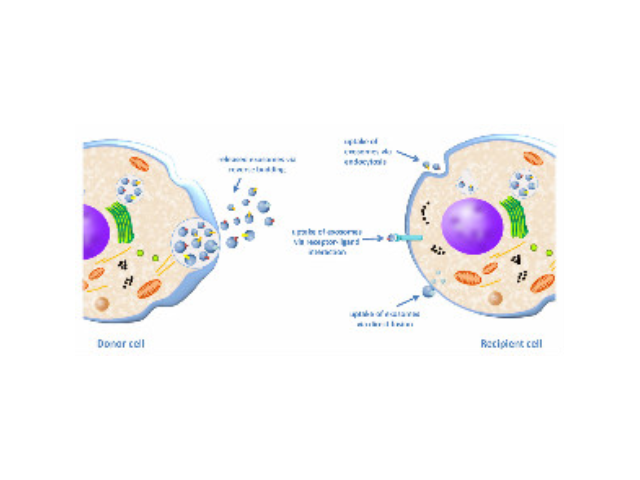
外泌体是指包含了复杂RNA和蛋白质的小膜泡(30-150nm),现今,其特指直径在40-100nm的盘状囊泡。1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。由于外泌体是一个大小约几十纳米的囊状小体,大于一般蛋白质。徐州正规外泌体提取试剂单价
聚乙二醇(PEG)可与疏水性蛋白和脂质分子结合共沉淀。珠海外泌体提取试剂单价
外泌体与神经退行性疾病:外泌体可能促进或限制大脑中未折叠和异常折叠的蛋白质的聚集。AD病人脑脊液外泌体中均可检测到Tau和Aβ蛋白。类似的现象也在PD和ALS疾病中发现。PD病人脑脊液外泌体可检测到α-synuclein,ALS病人外泌体中也可以检测到SOD1或TDP-43。外泌体与疾病诊断(应用潜能):外泌体生成机制表明,通过分析外泌体的组分,可以帮助识别其来源的细胞类型。这一特性已被应用于开发心血管疾病,神经系统疾病和一些病症的分子诊断方法,也在肝肾肺相关疾病中进行研发测试。珠海外泌体提取试剂单价
Exosome,中文名外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。外泌体具有脂质双层膜结构,能很好的保护其包被的物质,且能靶向特定细胞或...
- 上海正规外泌体提取试剂平均价格 2026-02-14
- 上海正规外泌体提取试剂厂家供应 2026-02-14
- 长沙外泌体提取试剂报价 2026-02-14
- 珠海外泌体提取试剂哪家好 2026-02-14
- 温州外泌体提取试剂哪家好 2026-02-13
- 昆明正规外泌体提取试剂 2026-02-13
- 厦门正规外泌体提取试剂价格 2026-02-13
- 长沙正规外泌体提取试剂哪家好 2026-02-12
- 唐山外泌体提取试剂直销价 2026-02-12
- 深圳正规外泌体提取试剂销售厂家 2026-02-12
- 芜湖正规外泌体提取试剂哪里买 2026-02-03
- 厦门外泌体提取试剂平均价格 2026-02-03
- 昆明外泌体提取试剂进货价 2026-02-03
- 徐州外泌体提取试剂厂家推荐 2026-02-03
- 北京正规外泌体提取试剂供应商 2026-02-03
- 温州外泌体提取试剂厂家推荐 2026-02-03


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14