- 产地
- 苏州
- 品牌
- 无血清细胞冻存液
- 型号
- 齐全
- 是否定制
- 是
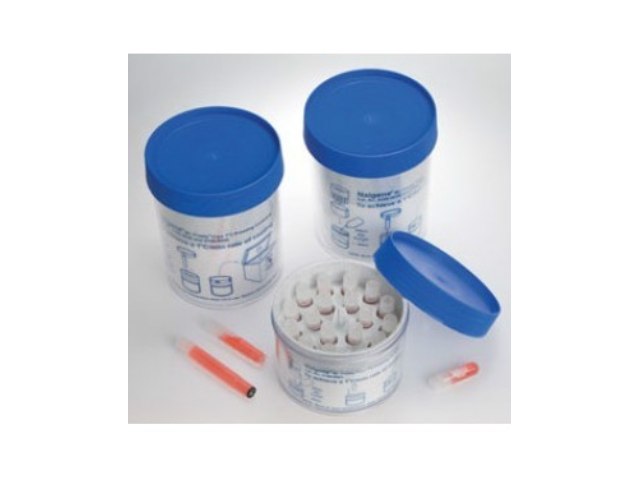
无血清细胞冻存液:采用patent的冻存配方,用包括重组人血白蛋白等多种蛋白组分替代了血清的用途。用包括DMSO在内的复合冻存保护剂替代了单一的DMSO的保护作用。复合保护剂的内部保护剂,易于穿透细胞膜,避免在细胞冻存过程中细胞内部的水分子形成冰晶损伤细胞;外部保护剂,可在溶液形成冰晶之前,在细胞膜外部竞争性的结合细胞膜表面的水分子,从而降低细胞外溶液的电解质浓度,减少阳离子进入细胞的数量。在细胞内部与外部的协同保护作用下,明显降低了温度迅速下降与温度上升对细胞的损害,因此大幅度提高了细胞经过冻存后的复苏存活率。待冻存管中细胞混合液完全融化后,立即加入1 ml细胞培养基于该冷冻管中与细胞混合。上海北京无血清细胞冻存液

细胞冻存和复苏的原则是:慢冻速融,这样更加有利于保持细胞的活力。冻存细胞不加任何保护剂,会导致细胞内冰晶的产生,从而使细胞产生内源性的机械损伤,引起细胞内环境渗透压,PH,电解质等的改变,进而促使细胞死亡。在过去的几十年中,科研工作者将培养基、血清和DMSO按照一定的比例配制成冻存液,并配合手工使细胞从4℃,-20℃,-80℃到液氮中逐步转移使其达到“慢冻”的效果。但这种自制的冻存液储存时间一般比较短,不能满足时间跨度大的实验项目的需求。且这样人力和时间成本大,人手操作的误差和血清制品的批间差也给实验结果带来了不稳定性。重庆无血清细胞冻存液在冻存细胞时将细胞悬浮于冻存液中,可使冰点降低,提高细胞膜对水的通透性。

细胞冻存时间和操作步骤:1、首先我们需要冻存培养液,通常细胞冻存液含10%的DMSO,或者是甘油、10-20%的小牛血清;、取对数生长期细胞,并且还需要用PBS进行清洗,需要注意在这里要丢弃掉旧的细胞冻存液;3.去除PBS,加入适量的胰蛋白酶,以覆盖住培养皿表面为宜,然后把单层生长的细胞消化掉;然后离心1000rpm5min时间;4、去除胰蛋白酶,加入冻存培养液,轻轻吹打使细胞的分布变得均匀,调节细胞较终的密度为5×106/ml-1×107/ml,需要注意这是较佳的细胞密度;5、将细胞装入冻存管之中,每管的含量应该保持在1~1.5ml之间。在冻存管上标明细名称、时间、操作者;6、较后要说的就是细胞冻存的时间了,对于标准的冻存程序来说,需要进行梯度降温,降温速率-1~-2℃/min,一旦温度达到-25℃以下时,那么就可增至-5℃~-10℃/min;等到-100℃的时候,可迅速的放入到液氮之中。
细胞冻存的注意事项:1.为保持细胞较大存活率,一般都采用慢冻存融的方法。2.冻存物距液氮面越近温度越低。标准的低冻速度为-1℃~12℃/分钟,当温度下降达-25℃时,下降速度可增至-5~-10℃/分钟,到-100℃时则可迅速冻入液氮中。因此要适当掌握冻存物下降入液氮中的速度,过快能影响细胞内水分透出,太慢则促冰晶形成。3.初次冻存者在下降冻存时,宜先用细木棒伸入罐中探测液面位置,然后需用温度计与冻存物并行的办法,以观测下降冻存物的速度、冻存物与液氮液面距离和温度三者关系,当已掌握以上各参数和冻存技术熟练后,光按下降时间和下降距离便可获理想冻存效果细胞冻存管一定要保证完全密封,否则在复苏过程中有可能会炸。

年连续三年成为新赛美全产品线中“受客户喜欢的科研产品”“无血清细胞冻存液关键技术及产业化”项目成功入围“2017年东吴科技创新创业人才计划“3优势分析传统冻存液CELLSAVING成分“血清+培养基+dmso”四大类,成分明确,不含血清安全性1、微生物污染风险2、批次不稳定1、无微生物污染风险险2、批次稳定操作1、4℃(40min)→20℃(30min)→80℃→液氮2、程序性降温盒(多人共用;异丙醇)直接冻于-80℃冰箱,长期保存效果活率偏低,批次有差异,不适用无血清细胞冻存90%以上,复苏后几乎看不到死细胞无血清冻存液特性:适合各种动物细胞。郑州无血清细胞冻存液单价
无血清细胞冻存液使用方法:加入适量的无血清型细胞冻存液于离心管中。上海北京无血清细胞冻存液
细胞冻存是细胞保存的主要方法之一。利用冻存技术将细胞置于-196℃液氮中低温保存,可以使细胞暂时脱离生长状态而将其细胞特性保存起来,这样在需要的时候再复苏细胞用于实验。而且适度地保存一定量的细胞,可以防止因正在培养的细胞被污染或其他意外事件而使细胞丢种,起到了细胞保种的作用。为什么要进行细胞冻存?连续培养的细胞系容易发生遗传漂变,有限细胞系较终会发生衰老,所有培养的细胞都易受到微生物污染,即使运转情况较好的实验室也会遇到设备故障的问题。由于已建立的细胞系是一种宝贵资源,更换细胞系成本高昂,而且耗费时间,因此,十分有必要将细胞冷冻起来长期保存。除此之外,还可以利用细胞冻存的形式来购买、寄赠、交换和运送某些细胞。上海北京无血清细胞冻存液
这是一款无血清即用型细胞保存液,比较大的特点就是无需程序降温盒及稀释,无需分步降温,直接使用!可在-80℃长期保存ES/iPS细胞、肿瘤细胞和常规细胞。冷冻细胞时,用1ml该细胞冻存液悬浮处于对数生长期的细胞,不需预冷,直接-80℃冷冻保存,也可用液氮快速冷冻细胞;复苏时用恒温箱或者水浴锅快速复苏细胞即可。不仅操作方便,更能提供稳定的冻存效果,获得更好的细胞活力。一款不需要放液氮罐也能长期保存的细胞冻存液试用装申请正在进行。。。无血清细胞冻存液的优势:即用型,无需现配,直接将细胞悬浮于冻存液中即可。青岛正规无血清细胞冻存液供应商无血清快速细胞冻存液,通用于各种动物细胞株。特别配方具有有效提高细...
- 昆明正规无血清细胞冻存液报价 2026-01-18
- 太原正规无血清细胞冻存液厂家直销 2026-01-18
- 开封无血清细胞冻存液哪家便宜 2026-01-17
- 温州无血清细胞冻存液直销厂家 2026-01-17
- 正规无血清细胞冻存液厂家批发价 2026-01-17
- 深圳无血清细胞冻存液报价 2026-01-17
- 杭州无血清细胞冻存液哪家好 2026-01-16
- 贵阳无血清细胞冻存液报价 2026-01-16
- 厦门无血清细胞冻存液报价 2026-01-16
- 长沙正规无血清细胞冻存液哪家便宜 2026-01-16
- 武汉正规无血清细胞冻存液厂家 2026-01-15
- 芜湖无血清细胞冻存液 2026-01-15
- 无血清细胞冻存液进货价 2026-01-15
- 南京深圳无血清细胞冻存液 2026-01-15
- 郑州无血清细胞冻存液厂家批发价 2026-01-15
- 昆明无血清细胞冻存液 2026-01-15


- 深圳正规外泌体提取试剂推荐厂家 01-19
- 无锡正规外泌体提取试剂单价 01-19
- 开封外泌体提取试剂供应商 01-19
- 天津RNA提取试剂产品介绍 01-19
- 厦门昆明RNA提取试剂 01-19
- 太原外泌体提取试剂平均价格 01-19
- 合肥外泌体提取试剂报价 01-19
- 如何使用糖原染色试剂盒报价 01-19
- 合肥细胞外基质胶服务电话 01-19
- 昆明细胞外基质胶厂家直销 01-19