- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
密度梯度离心法该方法由于比较繁琐,用的较少。原理是:像所有的脂质小囊泡一样,外泌体可以悬浮于特定密度梯度的蔗糖中,其密度范围1.13g/ml-1.21g/ml,将要分离外泌体的样本液体置于梯度蔗糖介质上,随后通过离心将外泌体分离。此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。具体步骤是:收集培养2d的上清液。将培养上清液先以1500r/min离心5min除去细胞及碎片,再依次以1000×g离心10min取上清,10000×g离心30min取上清,然后用100ku超滤离心管(Millipore)浓缩至15mL,形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关。合肥正规外泌体提取试剂直销厂家
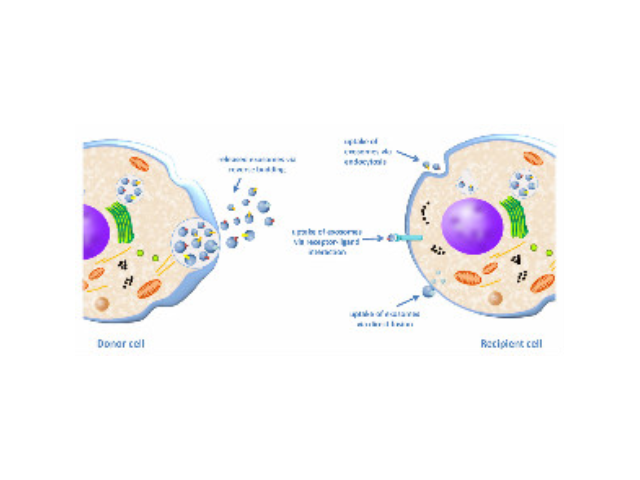
外泌体与免疫系统:不同的细胞来源的外泌体,包括免疫细胞(B细胞和树突状细胞)、病细胞、上皮细胞和间充质细胞,释放出带有载体的外泌体,可影响先天免疫系统和适应性免疫系统中受体细胞的增殖和各自的活性。CD4+和CD8+T细胞可直接或间接地受到外泌体的影响,刺激或压制其增殖和功能。外泌体与代谢性和心血管疾病:外泌体可以通过携带miRNA或代谢物分子在代谢性疾病和心血管疾病的发生的发展过程中起作用。体外培养心血管疾病的细胞收集的外泌体与疾病相关的代谢适应有关;体外培养的间充质干细胞和胚胎干细胞的外泌体具有保护心血管的作用。这些发现表明不同来源的外泌体可以通过传递miRNA,蛋白等物质改变受体细胞的代谢状态。外泌体检测作为一种新型的液体活检热点技术已被许多临床科研机构普遍地应用于一些病症和疾病的无创诊断。合肥正规外泌体提取试剂直销厂家外泌体的提取方法:磁珠免疫法。
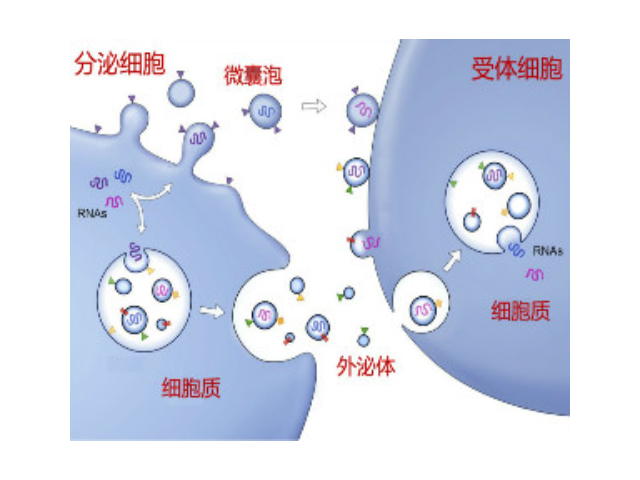
外泌体的提取方法,先用含无外泌体血清的培养基对人脂肪来源间充质干细胞进行饥饿培养,这样可使干细胞处于正常生长状态,不会被克制生长增殖,其所分泌的外泌体所包含的有效物质也更贴近其自然状态下的外泌体,然后将含有外泌体的培养上清液进行低速差速离心(即先一离心处理、再第二离心处理)以去除细胞及其碎片,用100kd超滤管对低速差速离心后的离心液进行超滤浓缩得到外泌体浓度更高的超滤液,将超滤液经过第三离心处理去除杂质后直接用0.22μm过滤器过滤除菌,过滤掉粒径为220nm以上的物质,进一步得到含颗粒粒径小于220nm的浓缩液,因超滤浓缩处理和第三离心处理使得液体量浓缩,这样过滤除菌效率得到较大提高,较后将浓缩液进行超速离心的第四离心处理分离提取到外泌体。
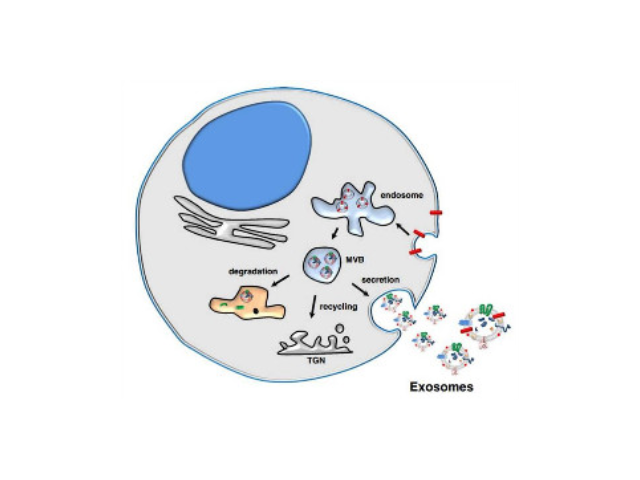
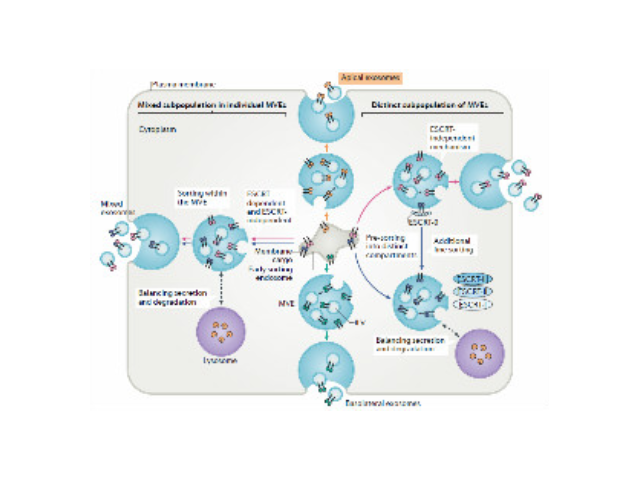
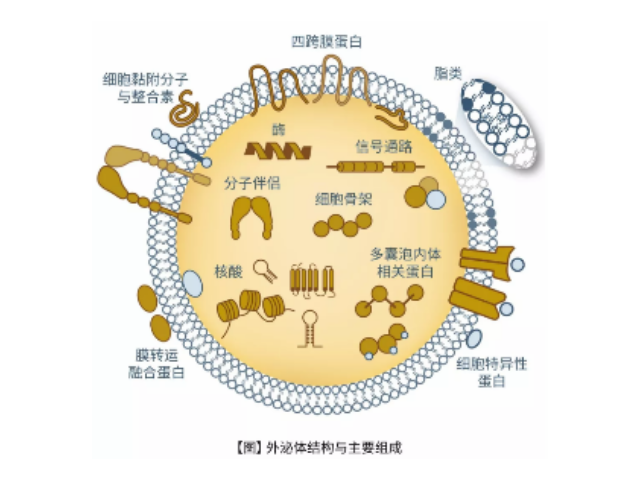
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键外泌体提取:高速离心以消除更大的囊泡。
2018版《指导要求》说明外泌体没有限定单一的分离手段,多种手段都可以进行细胞外囊泡的富集。《指导要求》编写者们认为“高回收率,低特异性”的富集手段是指那些富集囊泡的同时会有大量的非囊泡组分被富集,甚至细胞的整个分泌组都会被掺入其中,归入这一类的分离手段主要包括通过改变电荷或通过高聚物作用的沉淀试剂盒、低分子量截流的超滤分离、超长时间和超高离心力的超速离心等。Wako的MagCapture™ExosomeIsolationKitPS(产品编号299-77603(2tests),293-77601(10tests)),使用PS亲和法对外泌体进行提取,损失小且能获得高纯度的外泌体。外泌体提取:超滤膜也可用于分离外泌体。合肥正规外泌体提取试剂推荐厂家
专利申请利用分离培养人尿液来源细胞并收集培养基来进行体外培养。合肥正规外泌体提取试剂直销厂家
外泌体的提取、分离方法:微流控技术。微流控是利用微纳米级尺寸的管道来处理和操控流体所涉及的一门技术,其在外泌体分离方面的应用受到越来越多学者的关注。Jie等[16]课题组开发了一种三维纳米结构微流控芯片,微柱阵列通过化学沉积将交叉多壁碳纳米管功能化,然后其就可以识别特定的分子(CD63)并利用独特拓扑纳米材料高效的捕获外泌体。Wunsch等[17]利用硅工艺生产纳米级确定性侧向位移(Nano-DLD)芯片,得到了均匀的间隙尺寸,该芯片可以灵敏地将20~110nm的颗粒分离。该研究证明了外泌体基于大小的位移,从而揭示了利用芯片分选和量化纳米级生物胶体的潜力。合肥正规外泌体提取试剂直销厂家
Exosome,中文名外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。外泌体具有脂质双层膜结构,能很好的保护其包被的物质,且能靶向特定细胞或...
- 上海正规外泌体提取试剂平均价格 2026-02-14
- 上海正规外泌体提取试剂厂家供应 2026-02-14
- 长沙外泌体提取试剂报价 2026-02-14
- 珠海外泌体提取试剂哪家好 2026-02-14
- 温州外泌体提取试剂哪家好 2026-02-13
- 昆明正规外泌体提取试剂 2026-02-13
- 厦门正规外泌体提取试剂价格 2026-02-13
- 长沙正规外泌体提取试剂哪家好 2026-02-12
- 唐山外泌体提取试剂直销价 2026-02-12
- 深圳正规外泌体提取试剂销售厂家 2026-02-12
- 芜湖正规外泌体提取试剂哪里买 2026-02-03
- 厦门外泌体提取试剂平均价格 2026-02-03
- 昆明外泌体提取试剂进货价 2026-02-03
- 徐州外泌体提取试剂厂家推荐 2026-02-03
- 北京正规外泌体提取试剂供应商 2026-02-03
- 温州外泌体提取试剂厂家推荐 2026-02-03


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14