- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
转染的注意事项:细胞铺板密度用于转染的较佳细胞密度根据不同的细胞类型或应用而异。一般转染时,贴壁细胞密度为70%-90%,悬浮细胞密度为2×106-4×106细胞/ml时效果较好。确保转染时细胞没有长满或处于静止期。因为转染效率对细胞密度很敏感,所以在不同实验间保持一个基本的传代步骤很重要。铺板细胞数目的增加可以增加转染活性和细胞产量。在三种不同密度进行细胞铺板的比较表明铺板密度较高的,CAT活性也较高。得到较高活性所需的LIPOFECTAMINE试剂的量也相应增加了。这些结果说明,对于转染相同量的DNA所需的较佳阳离子脂质体试剂的量会因细胞密度而异~细胞易于生长到高密度并合成更多蛋白。成都细胞高效转染试剂价格

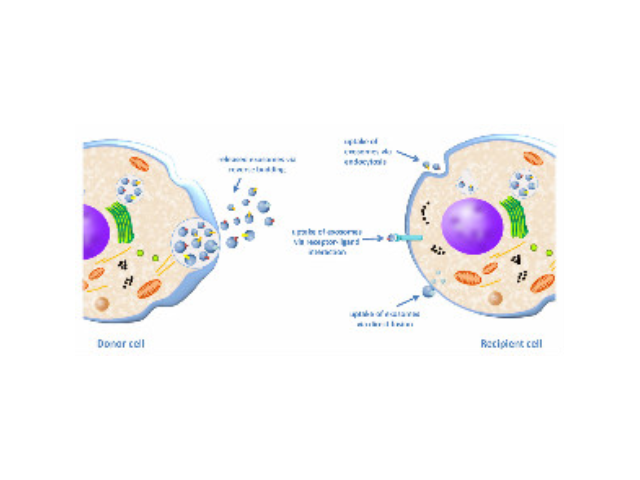
细胞转染实验简介:实验原理外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和细菌介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;细菌法是利用包装了外源基因的细菌传染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;细菌法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法~成都细胞高效转染试剂价格细胞转染是完成这一过程的必需步骤。

细胞转染的注意事项:细胞状态这点非常重要,不要急于求成,一定要让细胞处于较佳的生长状态再做。有文献说传代不要超过17代。细胞复苏后的3代左右时细胞状态较好,不要用传了很多代的细胞去做,细胞的形态都会发生变化。大多数已建立的细胞系都是非整倍体,原代培养包括了表达不同基因组合的细胞的混合物。细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。如果随时间发现这种变化,融化一管新鲜的细胞可能会恢复原先的转染活性。因此,如果观察到转染效率降低,可以试着转染新鲜培养的细胞以恢复较佳结果。或者,几种来源于经筛选,转染效率较高细胞亚系的细胞系现在有售~
如何提高细胞转染效率:1.组织培养试剂优化细胞生长条件。只使用新鲜配制的培养基和添加剂,并经可能减少所用试剂的变更。基础培养基—目前所使用的各种市售培养基(如,RPMI1640和DMEM)。培养基的成分包括营养物质(氨基酸,葡萄糖),维生素,无机盐,和缓冲物质。有些成分非常不稳定,因此如果不在使用时新鲜加入就可能会产生问题。务必要使培养基避光保存。因为已知有一些组分和缓冲物质,如HEPES,当暴露于光照下就会分解产生细胞毒性物质。另外,血清,添加剂,来自于培养箱内的污染物、化学物质,或/细胞的污染也都可能影响到细胞生理。2.细胞生长状态密切观察您的细胞;确保它们状态良好。在开始转染细胞之前,先制定一个适当的种板方案,使细胞密度从转染开始到结束都保持较佳状态。增加成功几率—细胞是转染过程中的一个关键元素,它可以是影响结果的一致性和质量的较重要的变量。瞬时表达分析检测未重组质粒DNA上基因的表达。

细胞转染,你至少要掌握以下几点:主要有下面几种方法::化学法:磷酸钙法、DEAE-右旋糖苷法、阳离子脂质体法;物理法:电穿孔法、显微注射法、颗粒传递法;细菌介导法:逆转录细菌、腺细菌A.阳离子脂质体法:带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。特点:简单通用,适用性广,转染效率高,重复性好,但转染时需除血清,转染效率随细胞类型变化大。由于脂质体复合物与贴壁细胞的接触机会远大于悬浮细胞,所以贴壁比悬浮转染效率要高。悬浮细胞建议使用电穿孔法。B.电穿孔法:利用高压电脉冲对细胞膜的干扰,使其形成利于核酸进入的微孔。直到外源基因在细胞分裂过程中因各种因素丢失为止。成都细胞高效转染试剂价格
能与核酸的磷酸根通过静电作用,将DNA分子包裹入内。成都细胞高效转染试剂价格
细胞转染的常用方法:磷酸钙共沉淀原理:该法可用于瞬时或稳定转染。然而因其对pH、温度和缓冲液盐浓度的微小变化十分敏感,所得结果容易出现差异,且对许多类型的细胞培养物(尤其是原代细胞)具有细胞毒性,转染效率较差。实验步骤:将核酸与氯化钙在磷酸盐缓冲液中混合,同时控制好pH、温度等条件→室温孵育,生成浓缩DNA的极小不溶性颗粒沉淀→将颗粒型沉淀分散到细胞中,促进DNA粘附在细胞表面→共沉淀通过内吞作用进入胞浆→分析细胞瞬时基因表达或者选择稳定性传染。成都细胞高效转染试剂价格
影响转染试验的因素:细胞状态变化:(1)转染试剂与细胞不匹配细胞转染较适合的不是原代细胞,也不是传代很多次的细胞。这是因为细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。较适合转染的细胞是经过几次传代后达到对数生长期的细胞,细胞生长旺盛,较容易转染。(2)把握时机没错!转染也有适当的时机,相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。因此对大多数转染操作而言,细胞都在转染当天或前现在种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态,如细胞数量过多,互相叠加,营养物质耗竭,代谢废物积聚,转...
- 厦门细胞高效转染试剂厂家供应 2026-02-09
- 昆明正规细胞高效转染试剂厂家直销 2026-02-08
- 青岛正规细胞高效转染试剂厂家批发价 2026-02-08
- 成都正规细胞高效转染试剂厂家推荐 2026-02-08
- 昆明正规细胞高效转染试剂供应商 2026-02-08
- 贵阳正规细胞高效转染试剂 2026-02-07
- 无锡细胞高效转染试剂厂家批发价 2026-02-07
- 成都细胞高效转染试剂哪家好 2026-02-07
- 昆明正规细胞高效转染试剂进货价 2026-02-07
- 昆明细胞高效转染试剂哪家好 2026-02-07
- 石家庄正规细胞高效转染试剂单价 2026-02-06
- 南京细胞高效转染试剂服务电话 2026-02-06
- 温州正规细胞高效转染试剂价格 2026-02-06
- 宁波细胞高效转染试剂价格 2026-02-06
- 唐山细胞高效转染试剂直销厂家 2026-02-06
- 济南正规细胞高效转染试剂哪里买 2026-02-06


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14