- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
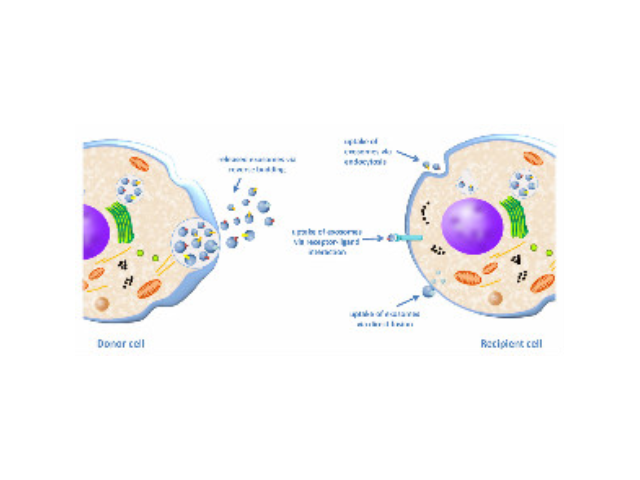
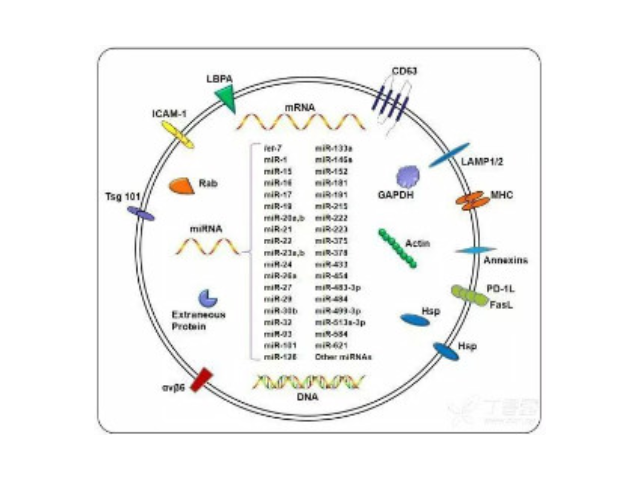
外泌体可通过流式、WB(检测指标有CD9,CD63,CD81)、电镜观察、NTA粒径追踪等手段检测,普遍应用于药物载体、疾病诊断marker、精细医疗、一些病症治病等方面研究。由于外泌体直径小,样本含量低,提取十分困难。已有的外泌体分离方式有密度梯度离心、超滤离心法、免疫磁珠抗体捕获、商用试剂盒等。但到目前为止,仍没有一种提取方法能同时保证外泌体的含量、纯度以及生物活性。外泌体是细胞间进行物质运输和信息交流的重要工具,可以通过调节免疫功能促进一些病症的增殖,血管新生和一些病症转移。与细菌传染,帮助细菌逃避免疫关系很大,并与心血管疾病,老年痴呆等疾病具有密切关系外泌体提取:免疫分离技术。金华正规外泌体提取试剂报价
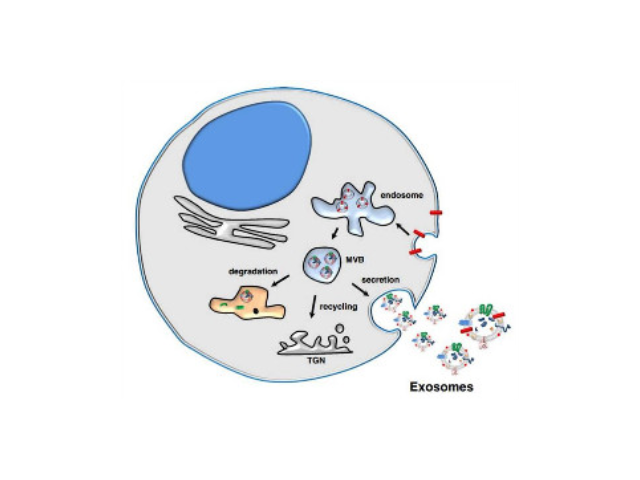
外泌体的提取方法:1、磁珠免疫法。外泌体表面有其特异性标记物(如CD63、CD9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点,但是效率低,外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。2、多聚物沉淀法。聚乙二醇(PEG)为常用的多聚物,可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集病毒,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。利用PEG沉淀外泌体存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏外泌体等成都外泌体提取试剂哪里买外泌体的提取方法:密度梯度离心。

外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。
有研究发现,NSCLC患者肺组织外泌体表面EGFR免疫染色呈阳性的占80%,而慢性肺炎组织的外泌体EGFR呈阳性的只占2%,因而认为外泌体的EGFR蛋白可以用作NSCLC与慢性肺炎鉴别诊断的生物标志物。Park等通过Sys-BodyFlu-id数据库分析发现153种特异性胸腔积液外泌体蛋白质,进一步的Westernblotting分析显示多种特异性胸腔积液外泌体蛋白参与EGFR信号传导途径以促进一些病症的发生的发展,因此外泌体蛋白可能作为肺病诊断筛查的生物学标记物。外泌体相关蛋白质与肺病的诊断:近年来众多文献报道,肺病细胞分泌的外泌体中富含多种蛋白质并促进肺病的发生的发展,是早期诊断肺病的有效途径。外泌体提取:重复离心操作还有可能对囊泡造成损害,从而降低其质量。
外泌体提取:尺寸排阻色谱。尺寸排阻色谱(Size-exclusionchromatography,SEC)是基于大小而非分子量实现分离大分子。该技术应用填充多孔聚合物微球的柱子,分子根据其直径通过微球,半径小的分子需要更长的时间才能通过色谱柱的孔隙迁移,而大分子则从色谱柱中更早地洗脱。尺寸排阻色谱可以精确分离大小分子。此外,可以将不同的洗脱溶液应用于该方法。与离心方法相比,色谱分离已被证明具有更多优势,因为通过色谱分离的外泌体不受剪切力的影响,这可能会改变囊泡的结构。目前,SEC是一种普遍接受的分离血液和尿液中外泌体的技术。不过,该方法耗时较长,不适合大量样本处理外泌体提取:样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,被流动相洗脱出来。外泌体提取试剂平均价格
外泌体提取:超离法因操作简单,获得的囊泡数量较多而广受欢迎。金华正规外泌体提取试剂报价
2018版《指导要求》说明外泌体没有限定单一的分离手段,多种手段都可以进行细胞外囊泡的富集。《指导要求》编写者们认为“高回收率,低特异性”的富集手段是指那些富集囊泡的同时会有大量的非囊泡组分被富集,甚至细胞的整个分泌组都会被掺入其中,归入这一类的分离手段主要包括通过改变电荷或通过高聚物作用的沉淀试剂盒、低分子量截流的超滤分离、超长时间和超高离心力的超速离心等。Wako的MagCapture™ExosomeIsolationKitPS(产品编号299-77603(2tests),293-77601(10tests)),使用PS亲和法对外泌体进行提取,损失小且能获得高纯度的外泌体。金华正规外泌体提取试剂报价
Exosome,中文名外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。外泌体具有脂质双层膜结构,能很好的保护其包被的物质,且能靶向特定细胞或...
- 上海正规外泌体提取试剂平均价格 2026-02-14
- 上海正规外泌体提取试剂厂家供应 2026-02-14
- 长沙外泌体提取试剂报价 2026-02-14
- 珠海外泌体提取试剂哪家好 2026-02-14
- 温州外泌体提取试剂哪家好 2026-02-13
- 昆明正规外泌体提取试剂 2026-02-13
- 厦门正规外泌体提取试剂价格 2026-02-13
- 长沙正规外泌体提取试剂哪家好 2026-02-12
- 唐山外泌体提取试剂直销价 2026-02-12
- 深圳正规外泌体提取试剂销售厂家 2026-02-12
- 芜湖正规外泌体提取试剂哪里买 2026-02-03
- 厦门外泌体提取试剂平均价格 2026-02-03
- 昆明外泌体提取试剂进货价 2026-02-03
- 徐州外泌体提取试剂厂家推荐 2026-02-03
- 北京正规外泌体提取试剂供应商 2026-02-03
- 温州外泌体提取试剂厂家推荐 2026-02-03


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14