- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
细胞转染的注意事项:细胞状态这点非常重要,不要急于求成,一定要让细胞处于较佳的生长状态再做。有文献说传代不要超过17代。细胞复苏后的3代左右时细胞状态较好,不要用传了很多代的细胞去做,细胞的形态都会发生变化。大多数已建立的细胞系都是非整倍体,原代培养包括了表达不同基因组合的细胞的混合物。细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。如果随时间发现这种变化,融化一管新鲜的细胞可能会恢复原先的转染活性。因此,如果观察到转染效率降低,可以试着转染新鲜培养的细胞以恢复较佳结果。或者,几种来源于经筛选,转染效率较高细胞亚系的细胞系现在有售~瞬时转染后,可在48h-72h细胞长满之后,提取细胞蛋白或者RNA。厦门细胞高效转染试剂厂家推荐

细胞转染效率低下的几个大坑:1.准备不足做脂质体转染的时候,在开展正式实验前要多做预试验,优化转染条件。优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。2.电压过大做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。这就要求我们多做预实验,多摸索条件。对于大多数细胞来说,其较佳电压位于250-1250v/cm。另外,就是进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是较强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6μg,如果﹥10μg,转染效率也较大降低。电击后,应该将DNA和细胞混合液在室温下放置10分钟,使细胞恢复损伤。广州细胞高效转染试剂直销价在瞬时转染质粒中往往都含有一个报告基。

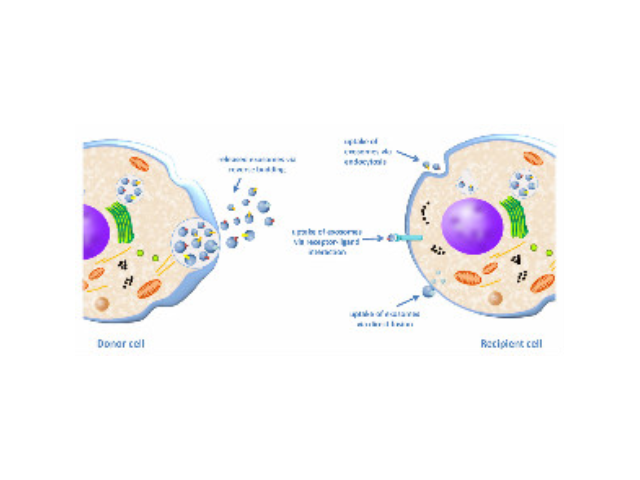
细胞转染实验简介:实验原理外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和细菌介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;细菌法是利用包装了外源基因的细菌传染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;细菌法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法
细胞转染操作方法:转染,是将外源性基因导入细胞内的一种专门技术。随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。转染大致可分为物理介导、化学介导和生物介导三类途径。电穿孔法、显微注射和基因属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种细菌介导的转染技术。理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。细菌介导的转染技术,是目前转染效率较高的方法,同时具有细胞毒性很低的优势。但是,细菌转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。其它物理和化学介导的转染方法,则各有其特点。对于贴壁细胞,一般要求在转染前一日,用胰酶处理为单细胞悬液。

细胞转染为什么不能加血清:不同的细胞及转染试剂要求转染的条件是不同的。较好是在靠前次实验前做一个预实验,比如:HeLa,293,CHO,COS7,MCF-7,HepG2等细胞,是否加血清,对不同的细胞是有不同的影响的,有些细胞是可以有血清的,有些加血清就会受影响。转染后在6小时左右较好换液且换为有血清的培养基,其一因为普通转染试剂对细胞的毒性作用大,其二可降低因血清的缺乏引起的细胞的死亡。转染时不加血清是防止血清的干扰作用,转染后可适时加入。加入过早会引起未转染细胞的优势生长,过晚会引起较多细胞死亡。可实时观察1/5细胞变圆的时候加入血清。细胞铺板密度用于转染的较佳细胞密度根据不同的细胞类型或应用而异。无锡正规细胞高效转染试剂平均价格
来指示细胞中目标基因是否存在,这样的报告基因一般可以在转染后一两天内检测到。厦门细胞高效转染试剂厂家推荐
细胞转染,你至少要掌握以下几点:主要有下面几种方法::化学法:磷酸钙法、DEAE-右旋糖苷法、阳离子脂质体法;物理法:电穿孔法、显微注射法、颗粒传递法;细菌介导法:逆转录细菌、腺细菌A.阳离子脂质体法:带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。特点:简单通用,适用性广,转染效率高,重复性好,但转染时需除血清,转染效率随细胞类型变化大。由于脂质体复合物与贴壁细胞的接触机会远大于悬浮细胞,所以贴壁比悬浮转染效率要高。悬浮细胞建议使用电穿孔法。B.电穿孔法:利用高压电脉冲对细胞膜的干扰,使其形成利于核酸进入的微孔。厦门细胞高效转染试剂厂家推荐
影响转染试验的因素:细胞状态变化:(1)转染试剂与细胞不匹配细胞转染较适合的不是原代细胞,也不是传代很多次的细胞。这是因为细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。较适合转染的细胞是经过几次传代后达到对数生长期的细胞,细胞生长旺盛,较容易转染。(2)把握时机没错!转染也有适当的时机,相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。因此对大多数转染操作而言,细胞都在转染当天或前现在种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态,如细胞数量过多,互相叠加,营养物质耗竭,代谢废物积聚,转...
- 厦门细胞高效转染试剂厂家供应 2026-02-09
- 昆明正规细胞高效转染试剂厂家直销 2026-02-08
- 青岛正规细胞高效转染试剂厂家批发价 2026-02-08
- 成都正规细胞高效转染试剂厂家推荐 2026-02-08
- 昆明正规细胞高效转染试剂供应商 2026-02-08
- 贵阳正规细胞高效转染试剂 2026-02-07
- 无锡细胞高效转染试剂厂家批发价 2026-02-07
- 成都细胞高效转染试剂哪家好 2026-02-07
- 昆明正规细胞高效转染试剂进货价 2026-02-07
- 昆明细胞高效转染试剂哪家好 2026-02-07
- 石家庄正规细胞高效转染试剂单价 2026-02-06
- 南京细胞高效转染试剂服务电话 2026-02-06
- 温州正规细胞高效转染试剂价格 2026-02-06
- 宁波细胞高效转染试剂价格 2026-02-06
- 唐山细胞高效转染试剂直销厂家 2026-02-06
- 济南正规细胞高效转染试剂哪里买 2026-02-06


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14