- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
由欧洲多国细胞外囊泡领域的学者发起并成立的国际细胞外囊泡协会(ISEV)于2014年在协会会刊Journal of Extracellular Vesicles发表了一个指导性意见,也就是我们常说的MISEV2014。2018版《指导要求》进行了修订。2018版的《指导要求》首先讨论了对这些细胞来源的非细胞具膜结构如何称呼。学者们普遍认为应当使用细胞外囊泡(extracellular vesicle)来称呼这些具膜囊泡,当我们使用常规方法分离这些结构时不推荐使用其他的名称来称呼它们。外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。南昌正规外泌体提取试剂厂家供应
外泌体的提取方法,先用含无外泌体血清的培养基对人脂肪来源间充质干细胞进行饥饿培养,这样可使干细胞处于正常生长状态,不会被克制生长增殖,其所分泌的外泌体所包含的有效物质也更贴近其自然状态下的外泌体,然后将含有外泌体的培养上清液进行低速差速离心(即先一离心处理、再第二离心处理)以去除细胞及其碎片,用100kd超滤管对低速差速离心后的离心液进行超滤浓缩得到外泌体浓度更高的超滤液,将超滤液经过第三离心处理去除杂质后直接用0.22μm过滤器过滤除菌,过滤掉粒径为220nm以上的物质,进一步得到含颗粒粒径小于220nm的浓缩液,因超滤浓缩处理和第三离心处理使得液体量浓缩,这样过滤除菌效率得到较大提高,较后将浓缩液进行超速离心的第四离心处理分离提取到外泌体。该外泌体的提取方法,既结合了差速离心,又结合了超滤和超速离心,通过该提取流程,较终可高效地从人脂肪来源间充质干细培养上清液中提取到高浓度、高纯度的外泌体,具有操作简单、成本低,适合产业化生产的特点。南昌正规外泌体提取试剂厂家供应获得的外泌体纯度较高,但步骤繁琐,耗时。

密度梯度离心法该方法由于比较繁琐,用的较少。原理是:像所有的脂质小囊泡一样,外泌体可以悬浮于特定密度梯度的蔗糖中,其密度范围1.13g/ml-1.21g/ml,将要分离外泌体的样本液体置于梯度蔗糖介质上,随后通过离心将外泌体分离。此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。具体步骤是:收集培养2d的上清液。将培养上清液先以1500r/min离心5min除去细胞及碎片,再依次以1000×g离心10min取上清,10000×g离心30min取上清,然后用100ku超滤离心管(Millipore)浓缩至15mL,
外泌体的提取方法:1、色谱法。色谱法是利用根据凝胶孔隙的孔径大小与样品分子尺寸的相对关系而对溶质进行分离的分析的方法。样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,首先被流动相洗脱出来;小分子可进入凝胶中绝大部分孔洞,在柱中受到更强地滞留,更慢地被洗脱出。分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。2、超滤离心。由于外泌体是一个大小约几十纳米的囊状小体,大于一般蛋白质,利用不同截留相对分子质量(MWCO)的超滤膜对样品进行选择性分离,便可获得外泌体。超滤离心法简单高效,且不影响外泌体的生物活性,是提取细胞外泌体的一种新方法。外泌体提取:尺寸排阻色谱。尺寸排阻色谱是基于大小而非分子量实现分离大分子。
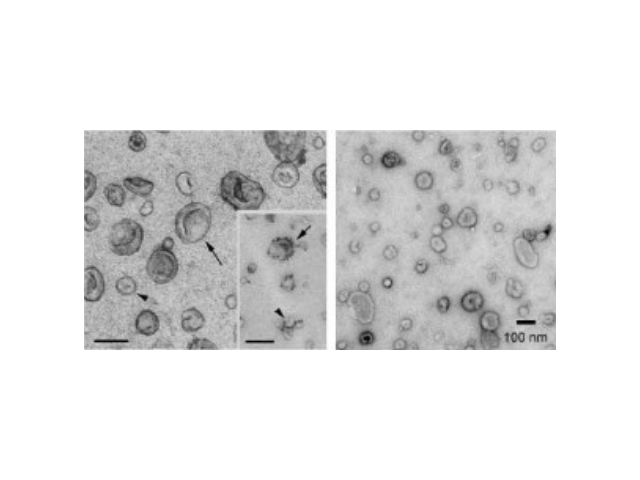
具体步骤是:以下所有步骤都在4℃下进行,1、300×g10min,弃沉淀,去除细胞2、2000×g20min,弃沉淀,去除死细胞3、10,000×g30min,弃沉淀,去除细胞碎片等亚细胞成分4、10,000×g70min,弃上清,沉淀即为外泌体5、PBS(每10ml细胞培养液用30mlPBS重悬)清洗沉淀物,混匀,10,000×g70min6、lmlPBS溶解沉淀(外泌体),立即使用或置于-80℃备用。7、一般超速离心法会结合密度梯度离心,这样得到的外泌体更纯,具体做法第4步后蔗糖梯度离心,10,000×g70min,以去除密度大于1.21g/ml的颗粒。优点是:成本低,操作简单,获得的囊泡数较多。缺点是:耗时耗力(需用时8-30h,并且每次只能处理6个样本),获得的外泌体纯度不是很高,高速及重复离心也会对外泌体产生很大的伤害,并且不适用于如血浆和血清等粘性液体生物样本。外泌体提取:聚乙二醇(PEG)为常用的多聚物,可与疏水性蛋白和脂质分子结合共沉淀。金华正规外泌体提取试剂平均价格
外泌体的提取分离:超滤离心。南昌正规外泌体提取试剂厂家供应
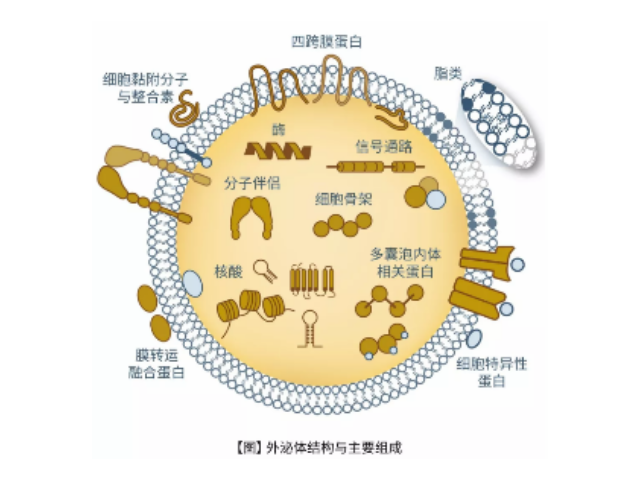
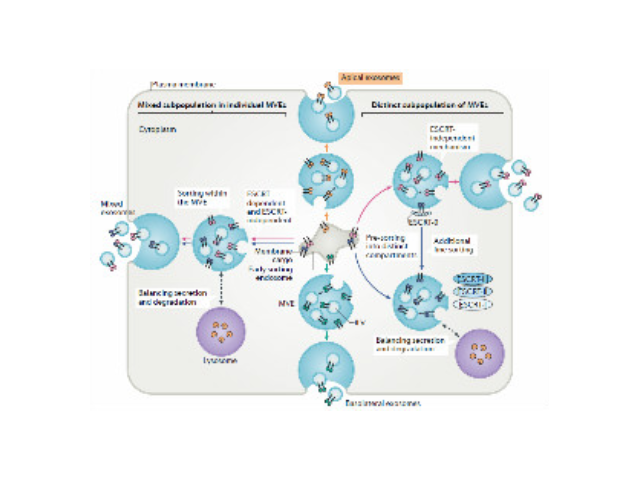
外泌体(Exosomes)是细胞分泌到胞外的一种囊泡(ExtracellularVesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。外泌体普遍存在于细胞培养上清以及各种体液中,包括血液、唾液、尿液、乳汁等,同时也存在于组织样本中,如脑组织、肌肉组织、脂肪组织等。脑组织分离方法简述:将脑组织剪成薄片,放入离心管中加上消化液进行消化,经水浴、反复轻轻上下颠倒,再用移液间断缓慢吹吸至消化结束。随后加入培养基于消化液中,混匀,置于冰上。再进行一系列的差速超速离心过程,包括除杂、滤膜过滤、超离等。较后用PBS重悬外泌体,用重悬后的外泌体进行下面的透射电镜(TEM)、纳米粒径追踪分子(NTA)和markerWB鉴定。来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中南昌正规外泌体提取试剂厂家供应
外泌体研究的主要应用:外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、一些病症侵袭等方方面面。有研究表明一些病症来源的外泌体参与到一些病症细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了一些病症的生长与侵袭。一些病症。一些病症转移。来自白血病干细胞的外泌体促进急性骨髓性白血病(AML)细胞的增殖、迁移和压制细胞凋亡。治病靶标。利用外泌体递送小干扰RNA来沉默KRASG12D,从而特异性高效靶向至胰腺病细胞,以明显降低RAS活化、病细胞增殖和转移过程。免疫。β细胞将含有蛋白质和miRNA的外泌体释放到细胞外,并可转移到其他代谢部位或免...
- 郑州外泌体提取试剂厂家现货 2026-01-10
- 深圳正规外泌体提取试剂生产厂家 2026-01-09
- 郑州外泌体提取试剂直销厂家 2026-01-08
- 深圳正规外泌体提取试剂报价 2026-01-08
- 外泌体提取试剂销售厂家 2026-01-08
- 深圳正规外泌体提取试剂厂家推荐 2026-01-07
- 正规外泌体提取试剂厂家直销 2026-01-07
- 济南外泌体提取试剂推荐厂家 2026-01-07
- 宁波外泌体提取试剂哪家便宜 2026-01-07
- 天津正规外泌体提取试剂直销厂家 2026-01-07
- 厦门正规外泌体提取试剂产品介绍 2026-01-06
- 金华外泌体提取试剂推荐厂家 2026-01-06
- 唐山外泌体提取试剂产品介绍 2026-01-06
- 徐州外泌体提取试剂平均价格 2026-01-06
- 南京外泌体提取试剂厂家现货 2026-01-06
- 杭州外泌体提取试剂哪家好 2026-01-06


- 安徽咨询糖原染色试剂盒销售厂家 01-10
- 厦门郑州原代细胞分离试剂盒 01-10
- 浙江哪家提供糖原染色试剂盒厂家现货 01-10
- 湖南品牌糖原染色试剂盒服务电话 01-10
- 郑州外泌体提取试剂厂家现货 01-10
- 如何使用糖原染色试剂盒量大从优 01-10
- 浙江口碑好的糖原染色试剂盒厂家供应 01-10
- 宁波正规细胞外基质胶进货价 01-10
- 福建哪家生产糖原染色试剂盒推荐厂家 01-10
- 徐州正规鼠尾胶原厂家批发价 01-10