- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
外泌体的生物学功能研究中需要分离完整的外泌体颗粒,而传统超速离心方法步骤繁琐、硬件要求高、操作难度大。李记生物自主开发的外泌体快速提取试剂盒,组分经过优化处理,适用于细胞培养上清液、血清、血浆、尿液及其他体液(脑脊液、腹水、羊水、乳汁以及唾液等)中的外泌体提取,并搭配纯化过滤装置,可快速高效地获得高纯度外泌体颗粒。注意事项:1.对于待测样品粘度过大时,可将样本用4℃预冷的1×PBS缓冲液进行等体积稀释处理。2.当血清、血浆、唾液等样品收获的外泌体浓度较高,收获的外泌体颗粒无法通过EPF柱纯化时,可用4℃预冷的1×PBS进行稀释后再通过EPF柱离心。3.针对外泌体标志蛋白(CD63,CD9,CD81等)进行Westernblot检测,可以鉴定所提的外泌体。通过超速离心(120000g/分钟)20小时以上才能获得足够的外泌体量。外泌体作为内源性的天然药物载体有着独特的优势,表面由脂质和蛋白质组成。外泌体提取试剂厂家供应

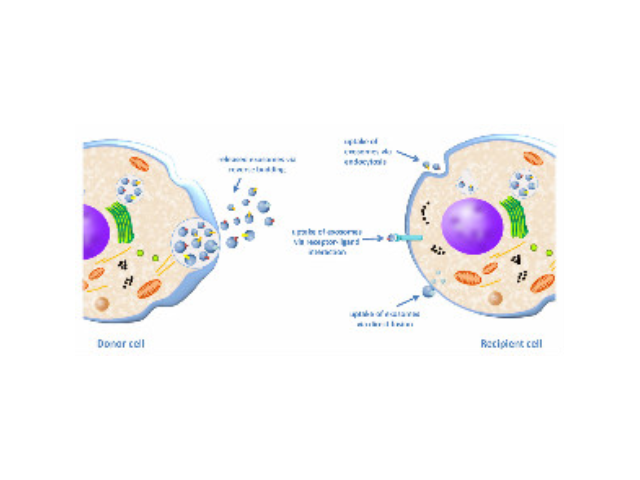
外泌体与神经退行性疾病:外泌体可能促进或限制大脑中未折叠和异常折叠的蛋白质的聚集。AD病人脑脊液外泌体中均可检测到Tau和Aβ蛋白。类似的现象也在PD和ALS疾病中发现。PD病人脑脊液外泌体可检测到α-synuclein,ALS病人外泌体中也可以检测到SOD1或TDP-43。外泌体与疾病诊断(应用潜能):外泌体生成机制表明,通过分析外泌体的组分,可以帮助识别其来源的细胞类型。这一特性已被应用于开发心血管疾病,神经系统疾病和一些病症的分子诊断方法,也在肝肾肺相关疾病中进行研发测试。将沉淀物用PBS缓冲液进行悬浮,使外泌体悬浮于液体上层昆明正规外泌体提取试剂供应商聚乙二醇(PEG)可与疏水性蛋白和脂质分子结合共沉淀。

外泌体的提取、分离方法:超高速离心法。常用的是超高速离心法,该方法是被誉为分离外泌体的“金标准”。该方法利用离心力从细胞培养液或生物流体获得外泌体,经过400×g、2000×g、10000×g的低速离心,除去细胞及大的细胞分泌物;较后超高速100000×g离心得到外泌体[12]。超高速离心因操作简单,不需要复杂的技术支持,并且成本相对较低而被普遍使用。但是该方法耗时、产率低,得到的外泌体的数量和质量很大程度上受转子的类型、转子沉降角度等因素影响,其中较主要的问题就是差速离心法获得的沉淀物是外泌体,但也会有其他的囊泡、蛋白质或蛋白和RNA的聚集体。
密度梯度离心法该方法由于比较繁琐,用的较少。原理是:像所有的脂质小囊泡一样,外泌体可以悬浮于特定密度梯度的蔗糖中,其密度范围1.13g/ml-1.21g/ml,将要分离外泌体的样本液体置于梯度蔗糖介质上,随后通过离心将外泌体分离。此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。具体步骤是:收集培养2d的上清液。将培养上清液先以1500r/min离心5min除去细胞及碎片,再依次以1000×g离心10min取上清,10000×g离心30min取上清,然后用100ku超滤离心管(Millipore)浓缩至15mL,外泌体提取:超离法是较常用的外泌体纯化手段,采用低速离心、高速离心交替进行。
外泌体的提取方法学规范、统一定量及鉴定等。关于外泌体的提取有超速离心、试剂盒、超滤法、蔗糖密度梯度离心等,然而各种方法均有其利弊。超速离心法是目前外泌体相关文章中的主流方法,由于离心步骤繁琐,费事费力,而且步骤多导致实验中容易污染,且损耗量大,使得较终回收的外泌体不稳定。而且对于抽提细胞上清来说,更是极为不请便,试想用提取300ml的上清需要6个50ml离心管,无论是过滤还是后续的每一步的离心去沉淀,都具有操作极其不便的缺点,总之非常麻烦。而超滤法存在外泌体会堵塞膜孔,造成浓缩效率低,浓缩管重复利用差,甚至堵塞在膜孔的外泌体还可能会粘连成团,造成损失及较后的数据有误差,对于后续实验也有影响。外泌体提取:样品中大分子不能进入凝胶孔,只能沿多孔凝胶粒子之间的空隙通过色谱柱,被流动相洗脱出来。郑州外泌体提取试剂推荐厂家
将人尿液来源细胞的培养基通过0.22微米滤膜过滤,以去除大的细胞残片以及其它杂质。外泌体提取试剂厂家供应
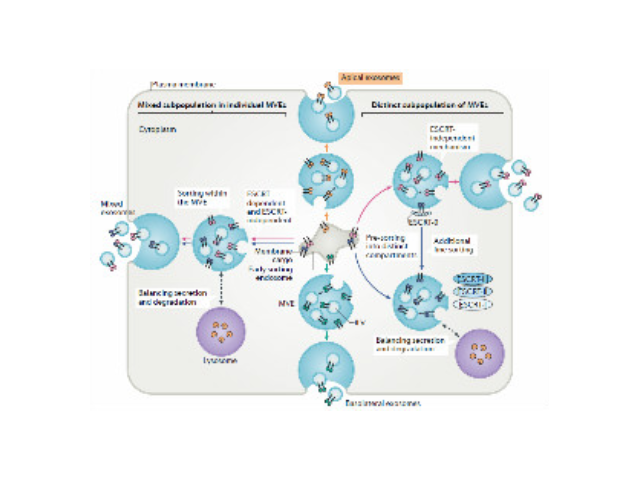
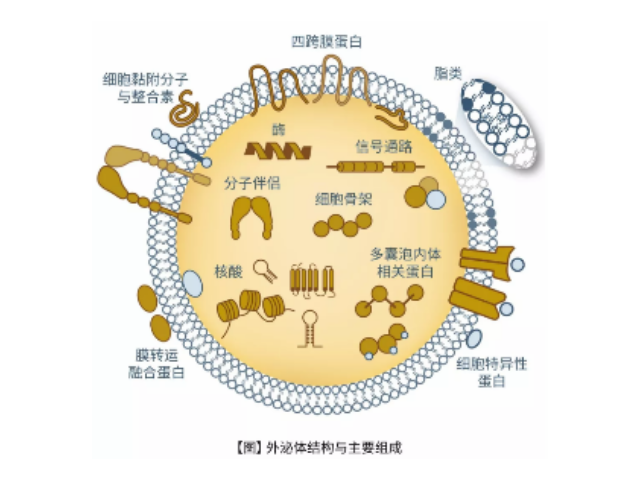
外泌体是一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110nm之间,其中包含RNA、蛋白质、microRNA、DN段等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。外泌体从发现至今已有30多年的历史,虽然较初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、一些病症细胞发生的发展、神经细胞信号转导过程中都发挥着重要作用。外泌体提取试剂厂家供应
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。外泌体提取:基于聚合物的沉淀技术。广州正规外泌体提取试...
- 郑州正规外泌体提取试剂厂家批发价 2026-01-14
- 合肥外泌体提取试剂生产厂家 2026-01-14
- 广州正规外泌体提取试剂直销价 2026-01-10
- 郑州外泌体提取试剂厂家现货 2026-01-10
- 深圳正规外泌体提取试剂生产厂家 2026-01-09
- 郑州外泌体提取试剂直销厂家 2026-01-08
- 深圳正规外泌体提取试剂报价 2026-01-08
- 外泌体提取试剂销售厂家 2026-01-08
- 深圳正规外泌体提取试剂厂家推荐 2026-01-07
- 正规外泌体提取试剂厂家直销 2026-01-07
- 贵阳正规外泌体提取试剂直销厂家 2026-01-06
- 金华正规外泌体提取试剂厂家直销 2026-01-06
- 上海外泌体提取试剂厂家 2026-01-06
- 厦门正规外泌体提取试剂产品介绍 2026-01-06
- 金华外泌体提取试剂推荐厂家 2026-01-06
- 唐山外泌体提取试剂产品介绍 2026-01-06


- 广州正规无血清细胞冻存液哪家便宜 01-15
- 厦门武汉无血清细胞冻存液 01-15
- 温州无血清细胞冻存液销售厂家 01-15
- 合肥成都无血清细胞冻存液 01-15
- 芜湖无血清细胞冻存液哪里买 01-15
- 珠海无血清细胞冻存液哪家便宜 01-15
- 长沙无血清细胞冻存液 01-15
- 长沙正规无血清细胞冻存液生产厂家 01-15
- 唐山正规无血清细胞冻存液报价 01-15
- 正规无血清细胞冻存液平均价格 01-15