- 产地
- 苏州
- 品牌
- 鼠尾胶原
- 型号
- 齐全
- 是否定制
- 是
一种基于鼠尾胶原蛋白制备的可吸收止血材料及其制备方法并在说明书中给出了原因:“一般的生物体中提取的胶原蛋白多为混合型,之前多从牛皮、猪皮、牛腱中提取,但这类胶原蛋白不仅有油脂等其他杂质,也存在着II型及其他一些胶原蛋白亚型;同时,这种畜牧业大量饲养的动物存在着例如疯牛病等一些生物性疾病及病毒,如果用此开发医用产品更加存在着品质的不稳定及潜在的风险及危害。”至此,想必“耗子尾汁”在知识产权界的名声又亮了一些。对于生物科研汪们来说,大白鼠、小白鼠们简直浑身是宝。无锡武汉鼠尾胶原

详细步骤如下:1.75%酒精浸泡大鼠尾巴30min;2.将尾巴剪开、去掉皮毛,并剪成小段(3cm左右),抽出银色的尾键;3.把剪碎的尾键置于150ml,0.1%消过毒的醋酸中,4℃放置,并不时振荡;4.48h后取上清,4000转离心30min后,取上清;5.分装上清(鼠尾胶)4度(或-20度)保存。有时可继续向4。中沉淀中加入10-20ml醋酸,重复以上步骤,以制备更多的鼠尾胶。在使用时,先将冰存的胶原液在室温下解冻,再按以下步骤包被培养器皿:1)用吸管吸取胶原液,在无菌的培养器皿的生长面内壁上均匀地涂上薄薄的一层胶原溶液。2)若包被的是培养瓶,可向培养瓶通入氨气或用浸有氨水的棉球封口片刻。让氨气充入瓶内后,即可旋紧瓶盖或塞紧瓶塞。若为培养皿或板的话,可将培养皿或板放在已消毒的饭盒内,将浸有氨水的棉球放入饭盒内,盖紧饭盒盖,四周用封口胶封死。无锡北京鼠尾胶原期间不断搅拌,防止冻结成块,得到胶原溶胀液。
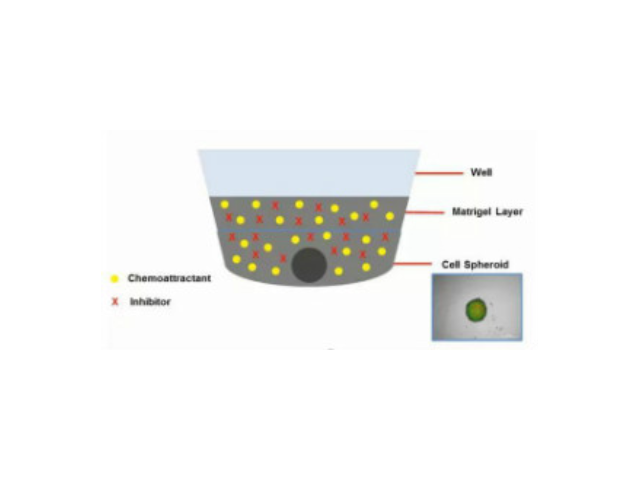
鼠尾胶原蛋白Ⅰ型使用说明:含细胞的三维胶原的制备(以配制1毫升,1mg/ml三维胶为例):准备好悬浮于培养液的细胞,并放置于冰浴中。将200ul鼠尾胶原蛋白I型(5mg/ml)加到12ul0.1mol/LNaOH中(如果反过来把12ul0.1mol/LNaOH加到胶原溶液中,会由于NaOH不能迅速混匀而产生局部的胶原凝结),立即混匀。再加入23ul10×PBS或10×培养液,混匀(混匀后pH为7左右,如果PBS或培养液中没有加酚红,初次使用时需要用pH试纸测试)。加入760ul的细胞悬浮液,混匀后立即加到培养器皿中。将培养器皿在室温下放置20分钟待胶凝固后,加入适当体积的细胞培养液,转移到培养箱中培养。论鼠尾胶原能促进毛细胞贴壁,涂布鼠尾胶原有利于膜片钳实验的长时程记录,并且制作简便,成本低廉。
对于生物科研汪们来说,大白鼠、小白鼠们简直浑身是宝,从毛发、皮肤,到心肝脾肺,甚至各种排泄物,都是我们重要的研究对象。尾巴,自然也是。所以耗子尾汁不仅存在,甚至是我们生物实验中必不可少的实验材料和实验对象。有不少人靠「耗子尾汁」发了CNS和顶刊。没有「耗子尾汁」,很多课题可能都没办法开展。在以小鼠为模式生物进行科学研究的实验室中,日常和基本的一个实验就是提取它们的遗传物质—DNA(脱氧核糖核酸)进行基因型鉴定,检测这些小动物的基因组中是否含有特定的DNA。可以理解为给小动物做核酸检测。将无组织纤维、脂肪和多糖残留的鼠尾腱,真空冷冻干燥备用。

含细胞三维胶原凝胶的制备(以配制1mg/mL三维胶1mL为例)准备好悬浮于培养液的细胞,并放置于冰浴中。将200μL本品加到12μL0.1mol/LNaOH中(如果反过来把12μL0.1mol/LNaOH加到胶原溶液中,会由于NaOH不能迅速混匀而产生局部的胶原凝结),立即混匀。再加入23μL10×PBS或10×培养液,混匀后立即加到培养器皿中(混匀后pH为7左右,如果PBS或培养液中没有加酚红,初次使用时需要测定pH值)。加入760μL的细胞悬浮液,混匀后立即加到培养器皿中。将培养器皿在室温放置20min待胶凝固后,加入适当体积的细胞培养液,转移到培养箱中培养。本品在室温下pH中性时可迅速成胶,在操作过程中要尽量保持低温。保存条件4℃保存,切勿冻存,有效期一年。鼠尾Ⅰ型胶原:选择适当的骨修复材料是治好骨缺损的中心环节。金华正规鼠尾胶原
在冰水浴中将粉碎的鼠尾腱在醋酸溶液中溶胀。无锡武汉鼠尾胶原
胶原蛋白的提取方法:1.碱法提取:碱法提取胶原蛋白常用的处理剂为石灰、氢氧化钠、碳酸钠等。如Holzer等[5]采用1%~1.5%石灰水浸泡的方法提取胶原蛋白。由于它容易造成肽键水解,因此得到的水解产物分子量比较低。所以,若想保留胶原的三股螺旋结构,此法不可取。2.盐法提取:盐法提取胶原蛋白所用的中性盐有盐酸-三羟甲基胺基甲烷(Tris-HCl)、氯化钠、柠檬酸盐等。在中性条件下,当盐的浓度达到一定量时,胶原溶解。并且可采用不同浓度的氯化钠对提取的胶原蛋白进行盐析处理,可以沉淀出不同类型的胶原蛋白。无锡武汉鼠尾胶原
胶原蛋白的功效与作用:1、可以作为一种补钙食品。胶原蛋白的特征氨基酸羟基脯氨酸是血浆中运输钙到骨细胞的运载工具,骨细胞中的骨胶原是羟基磷灰石的黏合剂,它与羟摹磷灰石共同构成了骨骼的主体。因此,只要摄入足够的胶原蛋白,就能保证正常机体钙质的摄入量,胶原蛋白可成制成补钙的保健食品。2、可以为特殊人群使用。妇科疾病的根源来自于内分泌失调,胶原蛋白能够改善妇科疾病的困扰,而更年期的妇女更需要胶原蛋白供给身体所需,使得更年期妇女能够更轻松面对各种不适。鼠尾胶原、多聚赖氨酸和明胶作为基质包被培养器皿。南昌正规鼠尾胶原供应商鼠尾胶原蛋白制备的可吸收止血材料及其制备方法。各个材料及其重量配比为鼠尾胶原蛋白∶聚...
- 成都鼠尾胶原厂家现货 2026-01-14
- 宁波南昌鼠尾胶原 2026-01-14
- 徐州正规鼠尾胶原报价 2026-01-14
- 唐山正规鼠尾胶原厂家直销 2026-01-14
- 济南正规鼠尾胶原价格 2026-01-14
- 杭州鼠尾胶原厂家批发价 2026-01-13
- 唐山鼠尾胶原哪家便宜 2026-01-13
- 宁波正规鼠尾胶原 2026-01-13
- 南京鼠尾胶原服务电话 2026-01-13
- 无锡正规鼠尾胶原厂家 2026-01-13
- 金华鼠尾胶原厂家推荐 2026-01-10
- 深圳鼠尾胶原价格 2026-01-09
- 石家庄鼠尾胶原产品介绍 2026-01-08
- 徐州昆明鼠尾胶原 2026-01-08
- 南京济南鼠尾胶原 2026-01-08
- 芜湖正规鼠尾胶原直销厂家 2026-01-08


- 南昌正规鼠尾胶原供应商 01-14
- 成都鼠尾胶原厂家现货 01-14
- 安徽正规糖原染色试剂盒哪家便宜 01-14
- 广州正规外泌体提取试剂服务电话 01-14
- 济南正规细胞外基质胶直销厂家 01-14
- 天津正规RNA提取试剂销售厂家 01-14
- 福建哪家提供糖原染色试剂盒报价 01-14
- 安徽咨询糖原染色试剂盒服务电话 01-14
- 宁波南昌鼠尾胶原 01-14
- 厦门正规细胞高效转染试剂厂家供应 01-14