- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
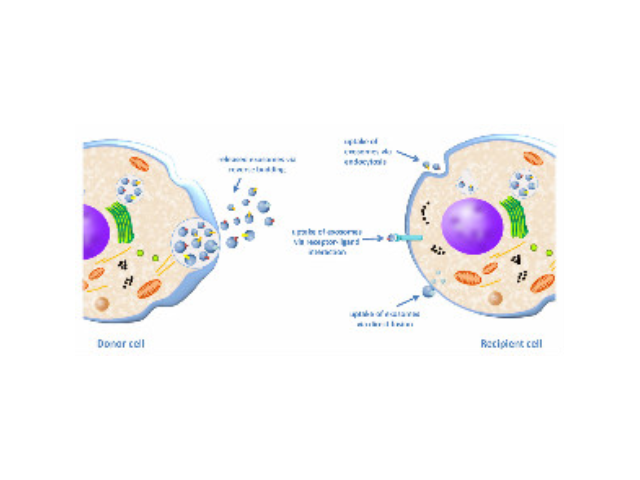
细胞转染实验的方法有哪些:1.脂质体法。中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。带正电的阳离子脂质体则不同,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。脂质体法始于1987年,此法的出现使得转染效率、转染的稳定性和可重复性较大提高。阳离子脂质体细胞毒性相对较高,对不同的细胞可能会干扰细胞的代谢。2.非脂质体转染。较新的纳米聚合物转染试剂,如Entranster试剂,纳米材料,细胞毒性小,转染效率高,渐渐成为各大实验室的选择转染试剂。可以使用一些营养丰富的无血清培养基,或者在转染培养基中使用血清。唐山细胞高效转染试剂推荐厂家

如何提高细胞转染实验效率:优化细胞生长状态密切观察您的细胞;确保它们状态良好。在开始转染细胞之前,先制定一个适当的种板方案,使细胞密度从转染开始到结束都保持较佳状态。增加成功几率—细胞是转染过程中的一个关键元素,它可以是影响结果的一致性和质量的较重要的变量。此外,还常用促有丝分裂刺激物(如,细菌转化,生长因子,条件培养基,以及滋养细胞)来活化原代培养细胞。贴壁细胞相比较悬浮细胞—在转染效率方面贴壁细胞和悬浮细胞之间的差异明显。天生趋于悬浮的细胞(如HL60,Jurkat)非常难以转染。相反,天生为贴壁的细胞(如HEK,CHO)则可适应悬浮生长的条件。唐山正规细胞高效转染试剂操作简便,对细胞毒性小,转染效率高受到研究者们的青睐。

转染技术:国际上推出了一些阳离子聚合物基因转染技术,以其适用宿主范围广,操作简便,对细胞毒性小,转染效率高受到研究者们的青睐。其中树枝状聚合物(Dendrimers)和聚乙烯亚胺(Polyethylenimine,PEI)的转染性能较佳,但树枝状聚合物的结构不易于进一步改性,且其合成工艺复杂。聚乙烯亚胺是一种具有较高的阳离子电荷密度的有机大分子,每相隔二个碳个原子,即每“第三个原子都是质子化的氨基氮原子,使得聚合物网络在任何pH下都能充当有效的“质子海绵”(protonsponge)体。这种聚阳离子能将各种报告基因转入各种种属细胞,其效果好于脂质聚酰胺,经进一步的改性后,其转染性能好于树枝状聚合物,而且它的细胞毒性低。大量实验证明,PEI是非常有希望的基因治好载体。目前在设计更复杂的基因载体时,PEI经常做为中心组成成分。
细胞转染效率低下的几个大坑:1.准备不足做脂质体转染的时候,在开展正式实验前要多做预试验,优化转染条件。优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。2.电压过大做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。这就要求我们多做预实验,多摸索条件。对于大多数细胞来说,其较佳电压位于250-1250v/cm。另外,就是进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是较强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6μg,如果﹥10μg,转染效率也较大降低。电击后,应该将DNA和细胞混合液在室温下放置10分钟,使细胞恢复损伤。因为DNA摄入效率和表达水平在不同实验中差异较大,实验必须很小心。

细胞转染操作方法:转染,是将外源性基因导入细胞内的一种专门技术。随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。转染大致可分为物理介导、化学介导和生物介导三类途径。电穿孔法、显微注射和基因属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种细菌介导的转染技术。理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。细菌介导的转染技术,是目前转染效率较高的方法,同时具有细胞毒性很低的优势。但是,细菌转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。一类是瞬时转染,一类是稳定转染(很长转染)。南昌细胞高效转染试剂单价
通过缓冲液的作用以及脂质与内体膜融合,增大内体的内部渗透压。唐山细胞高效转染试剂推荐厂家
细胞转染实验简介:实验原理外源基因进入细胞主要有四种方法:电击法、磷酸钙法和脂质体介导法和细菌介导法。电击法是在细胞上短时间暂时性的穿孔让外源质粒进入;磷酸钙法和脂质体法是利用不同的载体物质携带质粒通过直接穿膜或者膜融合的方法使得外源基因进入细胞;细菌法是利用包装了外源基因的细菌传染细胞的方法使得其进入细胞。但是由于电击法和磷酸钙法的实验条件控制较严、难度较大;细菌法的前期准备较复杂、而且可能对于细胞有较大影响;所以现在对于很多普通细胞系,一般的瞬时转染方法多采用脂质体法。唐山细胞高效转染试剂推荐厂家
影响转染试验的因素:细胞状态变化:(1)转染试剂与细胞不匹配细胞转染较适合的不是原代细胞,也不是传代很多次的细胞。这是因为细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。较适合转染的细胞是经过几次传代后达到对数生长期的细胞,细胞生长旺盛,较容易转染。(2)把握时机没错!转染也有适当的时机,相比较非分裂细胞——分裂细胞往往要比静止细胞更易于摄取并表达外源DNA。因此对大多数转染操作而言,细胞都在转染当天或前现在种板。同样重要的是细胞在种板进行转染时不应处于过度生长的状态,如细胞数量过多,互相叠加,营养物质耗竭,代谢废物积聚,转...
- 厦门细胞高效转染试剂厂家供应 2026-02-09
- 昆明正规细胞高效转染试剂厂家直销 2026-02-08
- 青岛正规细胞高效转染试剂厂家批发价 2026-02-08
- 成都正规细胞高效转染试剂厂家推荐 2026-02-08
- 昆明正规细胞高效转染试剂供应商 2026-02-08
- 贵阳正规细胞高效转染试剂 2026-02-07
- 无锡细胞高效转染试剂厂家批发价 2026-02-07
- 成都细胞高效转染试剂哪家好 2026-02-07
- 昆明正规细胞高效转染试剂进货价 2026-02-07
- 昆明细胞高效转染试剂哪家好 2026-02-07
- 石家庄正规细胞高效转染试剂单价 2026-02-06
- 南京细胞高效转染试剂服务电话 2026-02-06
- 温州正规细胞高效转染试剂价格 2026-02-06
- 宁波细胞高效转染试剂价格 2026-02-06
- 唐山细胞高效转染试剂直销厂家 2026-02-06
- 济南正规细胞高效转染试剂哪里买 2026-02-06


- 上海正规外泌体提取试剂平均价格 02-14
- 上海正规外泌体提取试剂厂家供应 02-14
- 太原RNA提取试剂直销价 02-14
- 杭州正规细胞外基质胶平均价格 02-14
- 长沙外泌体提取试剂报价 02-14
- 太原细胞外基质胶厂家供应 02-14
- 宁波正规无血清细胞冻存液厂家直销 02-14
- 开封RNA提取试剂厂家批发价 02-14
- 无锡武汉RNA提取试剂 02-14
- 温州RNA提取试剂哪里买 02-14