- 品牌
- 司鼎;OriCell
PCR的反应条件:dNTP浓度过高会加快反应速度,但同时还可以增加碱基的错误掺入率。引物浓度过高会引起错配和非特异性产物扩增。TaqDNA聚合酶浓度过高会引起错配和非特异性产物扩增,低则合成产物量减少。TaqDNA聚合酶无校正功能,掺入错误率达2*E-4个核苷酸,一个30个循环的扩增反应0.1%-0.25%总错误率。在90~95度下可使整个基因组的DNA变性为单链。一般94~95度30~60s。时间过长使TaqDNA聚合酶失活和dNTP破坏增多。DNA很快冷却到40~60度使引物和模板结合。引物长度在15~25时退火温度。重叠延伸聚合酶链反应可以将缺失、插入或点突变引入DNA序列。组织Real-time PCR
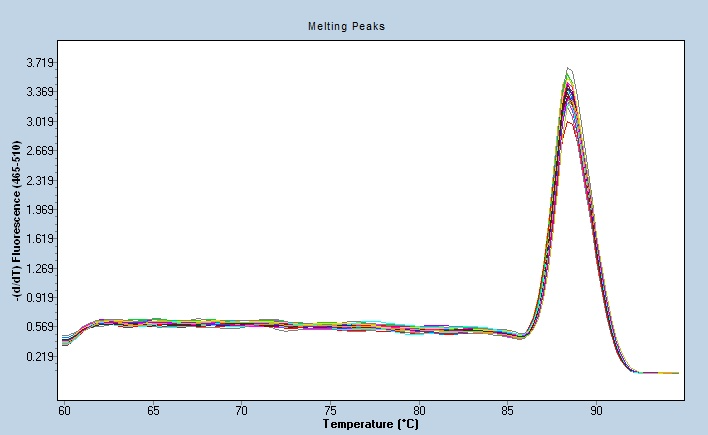
逆转录-聚合酶链反应的原理是:提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA。再以cDNA为模板进行PCR扩增,而获得目的基因或检测基因表达。完整RNA 的提取和纯化,是进行RNA 方面的研究工作,如Nothern杂交、mRNA 分离、RT-PCR、定量PCR、cDNA合成及体外翻译等的前提。所有RNA的提取过程中都有五个关键点,即样品细胞或组织的有效破碎;有效地使白复合体变性;对内源RNA酶的有效抑制;有效地将RNA从DNA和蛋白混合物中分离;对于多糖含量高的样品还牵涉到多糖杂质的有效除去。但其中很关键的是抑制RNA酶活性。RNA 的提取目前阶段主要可采用两种途径,提取总核酸,再用氯化锂将RNA 沉淀出来;直接在酸性条件下抽提,酸性下DNA与蛋白质进入有机相而RNA 留在水相。种提取方法将导致小分子量RNA 的丢失,目前该方法的使用频率已很低。组织Real-time PCR逆转录-聚合酶链反应较广用于表达谱,以确定基因的表达或鉴定RNA转录物的序列。
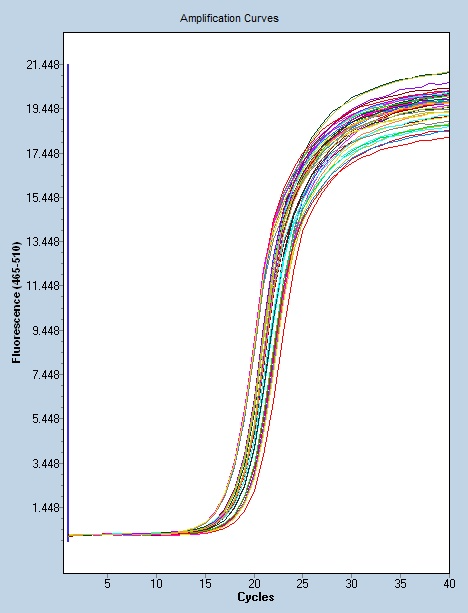
聚合酶链反应的一个主要限制是,为了产生允许其选择性扩增的引物,需要关于目标序列的先前信息。这意味着,通常情况下,PCR用户必须知道两个单链模板中每个模板上目标区域上游的精确序列,以确保DNA聚合酶正确结合引物-模板杂交体,并随后在DNA合成过程中产生整个目标区域。像所有酶一样,DNA聚合酶也容易出错,这反过来会导致产生的PCR片段发生突变。PCR的另一个限制是,即使是很少量的污染DNA也可以被扩增,导致误导或模糊的结果。为了很大限度地减少污染的可能性,调查人员应该为试剂制备、聚合酶链反应和产品分析预留单独的房间。试剂应分配到一次性的等分试样中。应经常使用带有一次性柱塞和超长移液器吸头的移液器。
聚合酶链式反应准备:10×扩增缓冲液、4种dNTP混合物(终浓度)、引物(终浓度)、模板DNA、Taq DNA聚合酶、Mg2+(终浓度)、补加双蒸水等。其中dNTP、引物、模板DNA、Taq DNA聚合酶以及Mg2+的加量(或浓度)可根据实验调整,以上表格只提供大致参考值。PCR反应五要素:参加PCR反应的物质主要有五种即:引物(PCR引物为DN段,细胞内DNA复制的引物为一段RNA链)、酶、dNTP、模板和缓冲液(其中需要Mg2+)。引物有多种设计方法,由PCR在实验中的目的决定,但基本原则相同。聚合酶链反应可以选择这些突变来理解蛋白质是如何完成其功能的,并改变或改善蛋白质功能。
聚合酶链反应的常见问题分析与解决方法:无扩增条带:酶失活或在反应体系中未加入酶。Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。模板含有杂质。特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5-10 min。引物变质失效。人工合成的引物是否正确。是否纯化,或因储存条件不当而失活。引物错误。利用BLAST检查引物特异性或重新设计引物。 DNA凝胶电泳时加入阳性对照,确保不是DNA凝胶和PCR程序的问题。聚合酶链反应可以用于分析病症、微生物或其他疾病状态中基因表达水平的变化。组织Real-time PCR
电子聚合酶链反应用于计算理论聚合酶链反应结果。组织Real-time PCR
聚合酶链式反应的试验污染:实验室中克隆质粒的污染:在分子生物学实验室及某些用克隆质粒做阳性对照的检验室,这个问题也比较常见。因为克隆质粒在单位容积内含量相当高,另外在纯化过程中需用较多的用具及试剂,而且在活细胞内的质粒,由于活细胞的生长繁殖的简便性及具有很强的生命力。其污染可能性也很大。污染的监测:一个好的实验室,要时刻注意污染的监测,考虑有无污染是什么原因造成的污染,以便采取措施,防止和消除污染。重复性试验。选择不同区域的引物进行PCR扩增。组织Real-time PCR
Real-time PCR-传统定量PCR:1)内参照法:在不同的PCR反应管中加入已定量的内标和引物,内标用基因工程方法合成。上游引物用荧光标记,下游引物不标记。在模板扩增的同时,内标也被扩增。在PCR产物中,由于内标与靶模板的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量待检测模板。2)竞争法:选择由突变克隆产生的含有一个新内切位点的外源竞争性模板。在同一反应管中,待测样品与竞争模板用同一对引物同时扩增(其中一个引物为荧光标记)。PCR反应的很大特点是具有较大扩增能力与极高的灵敏性。深圳微量荧光PCR设计公司Real-time PCR原理:基于探针...
- 珠海实时荧光定量PCR技术服务 2023-08-11
- 温州组织荧光PCR原理及步骤 2023-08-11
- 上海微量RT-PCR检测技术供应商 2023-08-11
- 珠海骨头Real-time PCR原理 2023-08-10
- 武汉血液数字PCR技术服务 2023-08-10
- 连云港血液数字PCR原理及步骤 2023-08-10
- 宁波骨头定量PCR应用 2023-08-09
- 武汉血液PCR检测技术设计公司 2023-08-09
- 苏州细胞Real-time PCR服务 2023-08-09
- 徐州实时PCR检测技术服务 2023-08-09
- 杭州细胞Real-time PCR原理及步骤 2023-08-08
- 上海特殊样本数字PCR哪家好 2023-08-07
- 常州特殊样本PCR检测技术哪家好 2023-08-07
- 珠海特殊样本定量PCR原理 2023-08-07
- 徐州实时Real-time PCR供应商 2023-08-07
- 上海血液荧光定量PCR原理 2023-08-07


- 绍兴多重免疫荧光用途 11-17
- 黄石组织芯片免疫荧光 11-14
- 东莞多重免疫荧光哪家好 11-12
- 淮南多种位点组织芯片定制 11-11
- 襄阳多种位点组织芯片特点 10-30
- 合肥组织芯片免疫组化哪家好 10-29
- 南京多种位点组织芯片用途 10-28
- 芜湖多种位点组织芯片技术服务 10-27
- 襄阳原位杂交哪家专业 10-26
- 武汉多重免疫荧光哪家好 10-25