- 品牌
- MCE,艾德莱,OriGene,abmart,ABW基质胶
尽管基质胶在类器官培养中具有明显优势,但其来源和成分的复杂性也带来了一些挑战。为了提高类器官培养的效率和 reproducibility,研究者们不断探索基质胶的优化与改进。例如,合成基质胶的开发为研究提供了更可控的环境,避免了动物来源材料的变异性。此外,通过添加特定的生长因子或调节基质胶的物理化学性质,可以进一步增强类的形成和功能。研究者们还在探索使用其他天然或合成的聚合物作为替代材料,以期找到更适合特定细胞类型或研究目的的培养基。这些优化措施为类研究的标准化和应用推广提供了新的可能性。基质胶支持肠道类器官形成隐窝-绒毛样结构。拱墅区肿瘤基质胶-类器官培养实验步骤

尽管基质胶在类器官培养中展现出巨大潜力,但仍面临一些挑战。首先,基质胶的来源和批次差异可能导致实验结果的不一致性,因此需要开发更为标准化的合成材料。其次,如何更好地模拟体内微环境,尤其是血管化和免疫反应等方面,仍是未来研究的重要方向。此外,随着技术的进步,结合基因编辑、单细胞测序等新兴技术,基质胶和类的研究将更加深入,推动再生医学和个性化医疗的发展。未来,基质胶与类的结合有望为疾病模型、药物筛选和组织工程等领域带来性的进展。高成功率基质胶-类器官培养如何申请试用动态培养系统可改善基质胶中类器官的营养供应。
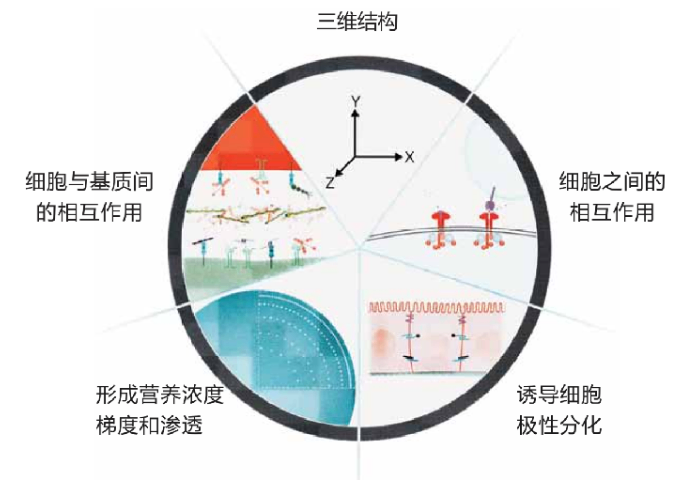
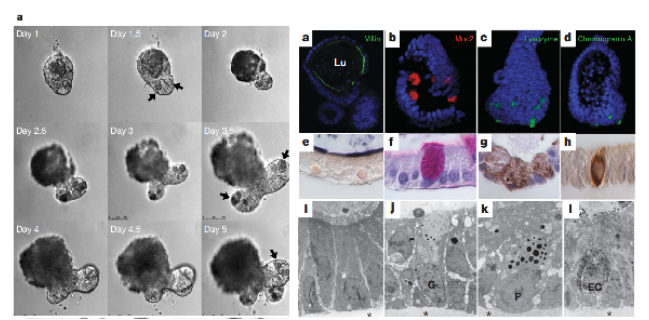
在类***培养中,基质胶作为支撑材料,提供了细胞生长所需的三维微环境。研究表明,基质胶能够有效促进干细胞向特定类型细胞的分化,从而形成具有特定功能的类***。例如,在肠道类***的培养中,基质胶为肠道上皮细胞的增殖和分化提供了理想的环境,促进了类***的形成和成熟。此外,基质胶中的生物活性因子能够调节细胞的信号传导通路,进一步增强类***的生长和功能。这种三维培养系统不仅提高了细胞的存活率,还能够更好地模拟体内的细胞间相互作用,为研究***功能和疾病机制提供了重要的实验平台。
类(Organoids)是指在体外培养的、具有一定组织结构和功能的细胞聚集体,能够模拟真实的生理特性。类的构建通常依赖于干细胞或组织特异性细胞在基质胶等三维培养基中的生长。与传统的二维细胞培养相比,类能够更真实地反映的微环境和细胞间的相互作用,因而在基础研究、药物筛选和疾病模型建立等方面具有广泛的应用潜力。例如,肠道类可以用于研究肠道疾病的机制,肝脏类则可以用于药物代谢和毒性测试。类的研究不仅推动了再生医学的发展,也为个性化医疗提供了新的思路。基质胶中TGF-β的缓释可增强类器官的基质细胞共培养效果。
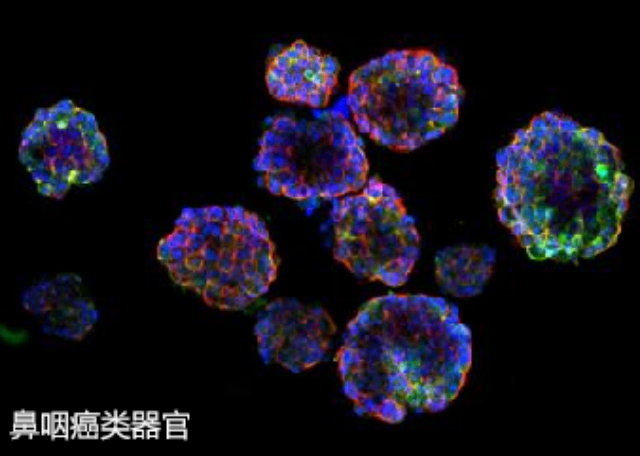
类***的培养为疾病模型的建立提供了新的思路。通过从患者的干细胞或组织中提取细胞,研究人员可以在基质胶中培养出与患者相似的类***。这些类***不仅能够模拟疾病的发生和发展过程,还能用于药物筛选和疗效评估。例如,在**研究中,类***可以用于评估不同化疗药物对肿瘤细胞的敏感性,从而为个性化***提供依据。此外,类***还可以用于研究遗传性疾病、***性疾病等,帮助科学家更好地理解疾病机制和寻找潜在的***靶点。尽管基质胶-类器官培养技术在生物医学研究中展现出巨大的潜力,但仍面临一些挑战。例如,如何提高类***的成熟度和功能性、如何实现大规模培养以满足临床需求等,都是当前研究的热点。此外,基质胶的来源和成分的复杂性也限制了其在临床应用中的推广。因此,未来的研究需要在优化培养基质、探索新型支撑材料以及提高类***的标准化和reproducibility等方面进行深入探索。随着技术的不断进步,基质胶-类器官培养有望在再生医学、个性化***和药物开发等领域发挥更大的作用。类器官在基质胶中的代谢活性可间接反映其健康状况。上城区肝癌基质胶-类器官培养
基质胶的降解速率应与类器官的生长速度相匹配。拱墅区肿瘤基质胶-类器官培养实验步骤
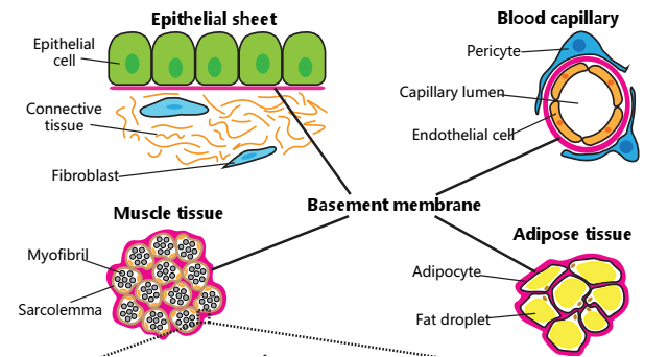
基质胶(Matrigel)是一种由基底膜成分组成的三维培养基,主要来源于小鼠的肿瘤细胞,富含胶原蛋白、层粘连蛋白、糖胺聚糖等多种生物活性分子。基质胶-类技术的应用与挑战基质胶类模型已广泛应用于疾病建模、药物筛选和再生医学:个性化医疗:利用患者来源类测试化疗敏感性;器官芯片:结合微流控技术模拟组织间相互作用;基因编辑研究:在类中验证CRISPR编辑效果。当前挑战包括标准化生产(如基质胶批次一致性)、血管化难题(多数类缺乏血管网络),以及成本控制(高纯度合成材料价格昂贵)。未来,开发可规模化、成分明确的仿生基质胶将是关键突破方向。拱墅区肿瘤基质胶-类器官培养实验步骤
- 干细胞分化基质胶-类器官培养如何申请试用 2025-12-04
- 临安区多层基质胶-类器官培养价格怎么样 2025-12-04
- 桐庐免疫共培养基质胶-类器官培养谁家好 2025-12-03
- 浙江基质胶-类器官培养市场报价 2025-12-03
- 临平区生长因子基质胶-类器官培养实验步骤 2025-12-03
- 杭州肿瘤基质胶-类器官培养供应商 2025-12-03
- 杭州多层基质胶-类器官培养如何申请试用 2025-12-03
- 余杭区ABW基质胶-类器官培养谁家好 2025-12-03