轮状病毒抗体是一种特异性识别轮状病毒的抗体,范围广应用于医学诊断、疫苗研发和流行病学研究领域。轮状病毒是引起婴幼儿急性胃肠炎的主要病原体之一,其感ran可导致严重腹泻、脱水和电解质紊乱,尤其在发展中国家具有较高的发病率和死亡率。轮状病毒抗体通过免疫学方法(如ELISA、免疫荧光和中和试验)检测轮状病毒的存在、浓度和感ran状态,为疾病诊断和防控提供重要依据。在医学诊断中,轮状病毒抗体用于检测患者粪便样本中的轮状病毒抗原,辅助急性胃肠炎的病因诊断。例如,通过ELISA法可以快速筛查轮状病毒感ran,为临床治*提供指导。在疫苗研发中,轮状病毒抗体用于评估疫苗的免疫原性和保护效果。例如,利用中和试验可以检测疫苗接种后产生的抗体水平,评估其对不同轮状病毒株的中和能力。在流行病学研究中,轮状病毒抗体用于监测病毒的流行趋势和基因型分布,为公共卫生政策的制定提供科学依据。轮状病毒抗体的优势在于其高特异性和灵敏度,能够准确识别轮状病毒的不同血清型和基因型。近年来,随着单克隆抗体技术的发展,轮状病毒抗体的特异性和稳定性得到进一步提升,为疫苗研发和疾病防控提供了有力支持。轮状病毒抗体的范围广应用。 中和抗体能够阻断病原体与宿主细胞的结合,抑制感ran过程。Glucagon抗体

CD19抗体是一种特异性识别CD19分子的单克隆抗体,在生物科研领域具有范围广的应用价值。CD19是一种B细胞特异性表面标志物,主要表达于B细胞及其前体细胞表面,是B细胞发育、分化和功能调控的关键分子。作为B细胞受体(BCR)信号复合物的重要组成部分,CD19参与调控B细胞的活化、增殖和信号传导过程。在基础研究中,CD19抗体是研究B细胞生物学的重要工具,常用于流式细胞术、免疫荧光染色和免疫组化等技术,用于鉴定、分离和定量B细胞群体。通过这些技术,研究人员可以深入探讨B细胞在免疫应答、免疫耐受以及相关信号通路中的作用机制。此外,CD19抗体还被范围广应用于构建B细胞特异性研究模型。例如,在转基因小鼠模型中,CD19抗体可用于标记和追踪B细胞的发育和分布,从而研究B细胞在免疫系统中的动态行为。在分子机制研究中,CD19抗体可用于免疫共沉淀(Co-IP)实验,帮助解析CD19与其他信号分子(如CD21、CD81等)的相互作用网络,进一步揭示B细胞活化和信号传导的分子基础。近年来,CD19抗体在免疫工程领域也展现出重要价值。例如,在嵌合抗原受体(CAR)技术的开发中,CD19抗体被用于构建靶向B细胞的工程化免疫细胞,为相关研究提供了强有力的工具。 Glucagon抗体抗体在干细胞研究中用于鉴定和分离特定细胞类型。

亲和层析纯化抗体是一种高效、特异的抗体纯化方法,利用抗原与抗体之间的高亲和力结合特性,从复杂混合物中分离和纯化目标抗体。该方法的重要是将抗原或抗体结合配体(如ProteinA、ProteinG)固定在层析介质上,形成亲和层析柱。当样品通过层析柱时,目标抗体与固定化配体特异性结合,而其他杂质则被洗脱去除。随后,通过改变洗脱条件(如pH或离子强度),目标抗体从层析柱上解离,较终获得高纯度的抗体样品。亲和层析纯化抗体在科研和工业领域具有范围广应用。在科研中,该方法用于从血清、细胞培养上清或杂交瘤培养液中纯化多克隆抗体和单克隆抗体,为WesternBlot、ELISA、免疫组化等实验提供高质量的抗体试剂。在工业领域,亲和层析是生物制药中抗体药物(如单克隆抗体药物)生产的关键步骤,确保药物的纯度和疗效。该方法的优势在于其高特异性、高回收率和高纯度。与传统的盐析法或离子交换层析相比,亲和层析能够一步实现抗体的高效纯化,较大简化了操作流程。近年来,随着新型配体(如ProteinL、多肽配体)和层析介质(如磁性微球)的开发,亲和层析的效率和应用范围进一步提升。亲和层析纯化抗体技术的不断优化,为抗体研究和生物制药提供了强有力的支持。
微管蛋白抗体是一种重要的研究工具,主要用于检测细胞中微管蛋白的表达和分布。微管蛋白是细胞骨架的关键组成部分,由α-和β-微管蛋白异二聚体聚合形成微管结构。微管在细胞中具有多种功能,包括维持细胞形态、参与细胞内物质运输、支持细胞分裂(如有丝分裂中的纺锤体形成)以及调控细胞运动等。在实验中,微管蛋白抗体范围广应用于免疫荧光、WesternBlot和免疫组化等技术中,用于观察微管在细胞中的动态变化及其在细胞周期中的作用。例如,通过免疫荧光染色,可以直观地看到微管在间期细胞中的网状分布以及在分裂期细胞中纺锤体的形成。此外,微管蛋白抗体还被用于研究微管相关疾病,如神经退行性疾病和aizheng,因为微管功能的异常与这些疾病的发病机制密切相关。选择高特异性和灵敏度的微管蛋白抗体对实验结果的准确性和可靠性至关重要。抗体的表位定位技术有助于解析抗原的结构特征。
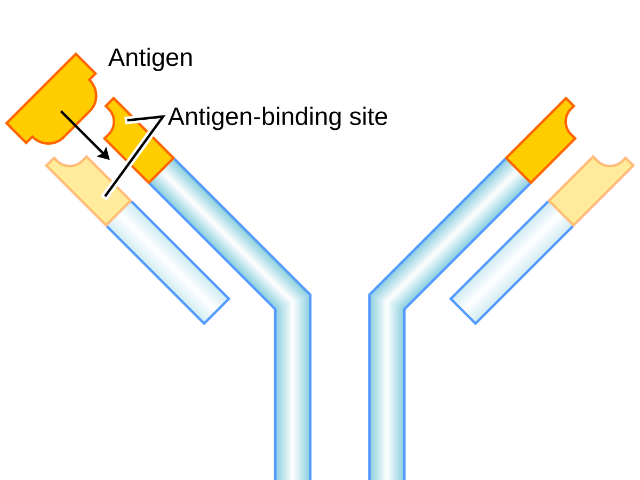
单克隆抗体是由单一B细胞克隆产生的高度特异性抗体,能够特异性地识别并结合单一抗原表位。其制备通常通过杂交瘤技术实现,即将免疫后的小鼠脾细胞与骨髓瘤细胞融合,形成杂交瘤细胞,这些细胞既能无限增殖,又能持续分泌特定抗体。单克隆抗体因其高特异性、均一性和可大规模生产的特点,在生物医学研究、疾病诊断和治*中具有广泛应用。在科研领域,单克隆抗体是重要的实验工具,用于蛋白质检测(如WesternBlot、ELISA)、细胞标记(如流式细胞术)以及功能研究(如免疫沉淀)。在临床诊断中,单克隆抗体被用于检测病原体(如病毒、细菌)和疾病标志物(如**标志物),为早期诊断提供可靠依据。在治*领域,单克隆抗体药物(如抗PD-1抗体、抗HER2抗体)已成为aizheng、自身免疫性疾病和感ran性疾病治*的重要手段。近年来,随着基因工程技术的进步,单克隆抗体的制备和应用得到了进一步优化。例如,人源化抗体和全人源抗体的开发减少了免疫原性,提高了治*安全性;双特异性抗体和抗体药物偶联物(ADC)则拓展了其治*潜力。单克隆抗体技术的不断发展,为疾病研究和治*提供了强有力的工具,推动了准确医疗的进步。抗体的高通量筛选平台加速了功能性抗体的开发进程。GATA6抗体
抗体的高通量生产技术支持大规模科研项目的需求。Glucagon抗体
在血管生物学研究中,CD34抗体也发挥着重要作用。由于CD34在血管内皮细胞中表达,它被范围广用于标记和追踪血管的形成和重塑过程。通过免疫荧光染色或免疫组化技术,研究人员可以利用CD34抗体观察血管内皮细胞的分布和形态,进而研究血管生成、血管修复以及相关信号通路的分子机制。此外,CD34抗体还被用于构建血管相关的体外模型,例如三维血管网络模型,为研究血管生物学提供了重要的实验平台。近年来,随着单细胞技术的发展,CD34抗体在单细胞水平研究中的应用也日益增多。例如,在单细胞RNA测序实验中,CD34抗体可用于筛选目标细胞群体,从而更精确地解析干细胞的异质性及其分化轨迹。这些研究不仅深化了对干细胞和血管生物学的理解,也为相关领域的创新研究提供了新的视角和工具。由于其高特异性和范围广的应用范围,CD34抗体已成为干细胞研究和血管生物学领域中不可或缺的重要试剂。 Glucagon抗体